2. Microscopia: Fundamento, Propiedades Ópticas y Tipos de Microscopios
2.1. El Microscopio Óptico Simple y Compuesto. Reglas Generales para su Uso
Introducción
El estudio de células animales, vegetales y microorganismos requiere técnicas que permitan visualizar estas estructuras, siendo la microscopía la disciplina encargada de ello. Un microscopio es un dispositivo diseñado para ampliar la imagen de objetos demasiado pequeños para ser vistos a simple vista, haciéndolos accesibles al ojo humano.
Se pueden definir los siguientes conceptos básicos:
- Microscopio: Instrumento óptico que aumenta la imagen de una muestra. Su nombre proviene de dos términos: micro (pequeño) y scopio (ver).
- Técnicas microscópicas: Métodos que utilizan microscopios como herramienta principal para la observación y análisis de muestras.
Existen diversos tipos de microscopios, clasificados según el tipo de iluminación que emplean:
- Microscopios ópticos de luz transmitida: La imagen se forma cuando la luz atraviesa la muestra. Entre ellos se encuentran:
- Microscopio de campo claro.
- Microscopio de campo oscuro.
- Microscopio de contraste de fases.
- Microscopio de contraste de interferencia.
- Microscopio invertido.
- Microscopios ópticos de luz reflejada: Basados en la reflexión de la luz sobre la superficie del objeto en observación. Algunos ejemplos incluyen:
- Microscopio de fluorescencia (epifluorescencia).
- Microscopio de luz ultravioleta.
- Microscopios electrónicos: En lugar de luz, utilizan un flujo de electrones para formar la imagen. Dentro de esta categoría se encuentran:
- Microscopio de barrido de sonda.
- Microscopio de sonda de electrones.
- Microscopio de transmisión.
- Microscopio de barrido y transmisión.
- Microscopio de barrido confocal: Es un tipo de microscopio electrónico que emplea fluorescencia para la visualización de estructuras en profundidad.
Propiedades Ópticas Fundamentales
Para comprender el funcionamiento de los microscopios, es necesario revisar algunos conceptos básicos de óptica. La luz está compuesta por partículas denominadas fotones, que transportan energía en forma de ondas electromagnéticas. Dependiendo de su interacción con los objetos, la luz puede comportarse de diferentes maneras:
- Reflexión: Ocurre cuando la luz incide sobre una superficie y cambia de dirección sin atravesarla.
- Refracción: Se produce cuando la luz pasa de un medio a otro con distinta densidad, cambiando su dirección y velocidad.
Lentes y su función
Las lentes son elementos ópticos diseñados para modificar la trayectoria de los rayos de luz, permitiendo la ampliación o reducción de imágenes. Se pueden clasificar en dos tipos principales:
- Lentes convergentes o convexas: Dirigen los rayos de luz paralelos hacia un punto focal común, produciendo una imagen ampliada del objeto. Son más gruesas en el centro que en los bordes.
- Lentes divergentes o cóncavas: Dispersan los rayos de luz paralelos, generando una imagen más pequeña del objeto. Son más delgadas en el centro que en los extremos.
Defectos ópticos de las lentes
Las lentes pueden presentar ciertas imperfecciones que afectan la calidad de la imagen:
- Aberración esférica: Ocurre cuando los rayos de luz que pasan por los bordes de la lente no convergen en el mismo punto focal, generando una imagen borrosa. Se corrige parcialmente utilizando un diafragma de iris o combinaciones de lentes con distintas curvaturas.
- Aberración cromática: Se manifiesta como anillos de colores alrededor de los objetos observados debido a la dispersión de la luz en diferentes longitudes de onda. Este problema se minimiza con el uso de lentes múltiples diseñadas para corregir la distorsión del color.
Características Principales de los Microscopios
Las diferencias entre los distintos tipos de microscopios dependen de dos factores clave:
- Resolución: Capacidad del microscopio para distinguir detalles en una imagen. Está influenciada por la calidad de las lentes, la longitud de onda de la luz utilizada (es inversamente proporcional a ella), el índice de refracción del medio y el tamaño del objetivo. Cuanto mayor sea el objetivo, mayor cantidad de luz podrá captar y, por lo tanto, mejor resolución tendrá la imagen.
- Aumento de la imagen: Se refiere a la capacidad del microscopio para ampliar un objeto hasta hacerlo visible al ojo humano. Se logra combinando el aumento del ocular y del objetivo.
Estos principios permiten la observación y estudio de estructuras microscópicas en diversas disciplinas científicas, desde la biología y la medicina hasta la nanotecnología y la investigación de materiales.
Términos que Describen las Características Ópticas de un Microscopio
Para comprender el funcionamiento y el rendimiento de un microscopio, es importante conocer una serie de términos que definen sus propiedades ópticas.
1. Aumento del Microscopio
El aumento se refiere a la relación entre el tamaño de la imagen observada a través del microscopio y su tamaño real cuando se ve a simple vista. Se calcula multiplicando el aumento del objetivo por el del ocular.
2. Contraste
El contraste se refiere a la diferencia visual entre una muestra y su entorno. Para que un objeto sea perceptible al observarlo con un microscopio, debe presentar cierto grado de contraste con el medio que lo rodea. Este contraste puede mejorarse mediante técnicas de tinción, que resaltan las estructuras de interés.
3. Poder de Resolución
La resolución es la capacidad del microscopio para distinguir detalles en una imagen, permitiendo diferenciar dos puntos cercanos como entidades separadas.
El poder de resolución depende de la longitud de onda de la luz utilizada y de la apertura numérica del sistema de lentes. Se expresa mediante la siguiente ecuación:
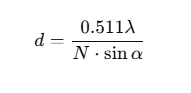
Donde:
- λ (lambda) es la longitud de onda de la luz empleada, que en los microscopios ópticos varía entre 400 y 700 nm.
- α (alfa) representa la mitad del ángulo de apertura del objetivo.
- N es el índice de refracción del medio situado entre la muestra y la lente.
Cuando se utilizan objetivos secos, el índice de refracción es 1 (el del aire). En cambio, si se emplea aceite de inmersión, este valor aumenta hasta 1.56, mejorando la resolución del microscopio.
En condiciones óptimas, con luz visible de longitud de onda más corta (alrededor de 426 nm) y un objetivo de máxima apertura numérica, la resolución máxima alcanzada por un microscopio óptico es de aproximadamente 200 nanómetros, lo que significa que dos puntos situados a una distancia menor no podrán distinguirse como entidades separadas.
4. Apertura Numérica (NA)
La apertura numérica es un valor que mide la capacidad de una lente para recolectar y enfocar la luz. Se determina mediante la ecuación:
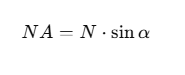
Donde:
- N es el índice de refracción del medio.
- α es la mitad del ángulo de apertura del objetivo.
Una mayor apertura numérica permite obtener imágenes más luminosas y con mayor nivel de detalle. Cuando el medio entre la muestra y el objetivo es aire, la apertura numérica no suele superar 0.65. Sin embargo, si se utiliza aceite de inmersión, se pueden alcanzar valores de hasta 1.4, logrando una mejora en la resolución de la imagen.
5. Longitud Mecánica del Tubo
Es la distancia entre la superficie donde se fija el objetivo en el revólver y el extremo del tubo donde se inserta el ocular. Este parámetro influye en la correcta alineación y funcionamiento del sistema óptico del microscopio.
6. Distancia de Trabajo
La distancia de trabajo es el espacio entre la lente del objetivo y la superficie de la muestra cuando la imagen está enfocada. A medida que aumenta el poder de magnificación del objetivo, esta distancia se reduce.
7. Número de Campo
Hace referencia al diámetro del campo de visión observable a través del ocular, expresado en milímetros. Cuanto mayor sea este número, mayor será la porción de la muestra visible al observarla con el microscopio.
8. Campo Real de Observación
Es el diámetro de la zona circular de la muestra que se visualiza directamente a través del microscopio. Se determina a partir del número de campo y del aumento total del sistema óptico.
9. Profundidad de Foco
Corresponde al grosor de la muestra que aparece nítido y en foco bajo el microscopio. A mayor apertura numérica del objetivo, menor será la profundidad de foco, lo que significa que solo una sección más delgada de la muestra permanecerá enfocada a la vez.
Dato Curioso
La lente más antigua conservada es la lente de Nimrud, fabricada en el antiguo Imperio Asirio alrededor del año 750 a. C.. Esta pieza demuestra que la manipulación de la luz mediante lentes es una práctica que se remonta a miles de años atrás.
Microscopios Ópticos
El microscopio óptico es uno de los instrumentos más básicos utilizados en la observación de estructuras microscópicas. Su funcionamiento se basa en el uso de luz visible y un sistema de lentes que amplifican la imagen de la muestra, permitiendo que el ojo humano la perciba con mayor detalle. En este apartado, nos enfocaremos en los microscopios ópticos compuestos, es decir, aquellos que cuentan con un sistema de oculares y objetivos. Por otro lado, los microscopios simples, conocidos comúnmente como lupas, no tienen una aplicación relevante en el ámbito clínico.
¿Sabías que…?
No se puede atribuir con certeza la invención del microscopio a una sola persona. Aunque algunas fuentes indican que Zacharias Janssen fue el creador del microscopio compuesto en 1590, otros registros sugieren que el verdadero inventor podría haber sido Hans Lippershey.
Componentes del Microscopio Óptico
El microscopio óptico consta de tres partes principales: el sistema óptico, la fuente de iluminación y el soporte mecánico. A continuación, se detallan sus componentes:
Sistema Óptico
- Oculares: Lentes ubicadas cerca del ojo del observador que amplían la imagen generada por el objetivo.
- Objetivos: Lentes situadas cerca de la muestra que captan la imagen primaria y la amplían antes de ser observada a través del ocular.
- Revólver: Dispositivo giratorio que sostiene los objetivos y permite cambiarlos según la magnificación deseada.
- Condensador: Sistema de lentes encargado de concentrar la luz sobre la muestra.
- Diafragma de apertura: Regula la cantidad de luz que atraviesa la muestra para mejorar la resolución y el contraste.
- Lente de campo: Responsable de proporcionar una iluminación uniforme en la imagen observada.
Fuente de Iluminación
- Lámpara halógena: Fuente de luz que ilumina la muestra, permitiendo su visualización a través del sistema óptico.
- Espejo de reflexión: Dirige la luz hacia la muestra en algunos modelos de microscopios sin iluminación interna.
- Difusor: Dispersa la luz de manera uniforme sobre la muestra para evitar sombras o reflejos indeseados.
Estructura Mecánica
- Base: Proporciona estabilidad al microscopio y sostiene todas sus partes.
- Columna: Estructura vertical que conecta la base con el tubo óptico y otros componentes.
- Platina: Superficie donde se coloca la muestra para su observación. Cuenta con un orificio central para permitir el paso de la luz.
- Mandos de control del movimiento de la platina: Permiten desplazar la muestra en diferentes direcciones para su correcta visualización.
- Mandos de enfoque macro y micro: Se utilizan para ajustar la nitidez de la imagen mediante movimientos gruesos (macrométrico) y finos (micrométrico).
Partes del Microscopio y su Función
Soporte Mecánico
El microscopio cuenta con una estructura que sostiene y estabiliza el sistema óptico, facilitando su uso.
- Pie o soporte: Pieza pesada que proporciona estabilidad al microscopio y evita movimientos indeseados.
- Columna: Conecta el pie con el tubo portaoculares y permite su ajuste en altura.
- Tubo portaoculares: Alberga los oculares en la parte superior y los objetivos en la inferior. Se ajusta en altura mediante un mecanismo de cremallera o tornillos de enfoque.
- Platina: Superficie donde se coloca la muestra, cuenta con un diafragma ajustable para controlar la cantidad de luz que la atraviesa.
Sistema de Lentes
El microscopio óptico emplea un conjunto de lentes para ampliar la imagen de la muestra. Este sistema está compuesto por dos lentes principales:
- Oculares: Situados en la parte superior del microscopio, permiten la observación de la imagen generada por los objetivos. Generalmente, tienen un aumento estándar de 10x.
- Objetivos: Se encuentran en la parte inferior del tubo óptico y captan la imagen primaria. Suelen estar organizados en un revólver y tienen diferentes aumentos, como 4x, 10x, 40x y 100x.
Tipos de Oculares en los Microscopios Ópticos
Existen diferentes tipos de oculares que varían según su diseño y función:
- Ocular de Huygens (negativo): Está compuesto por dos lentes separadas por un diafragma, proporcionando una imagen ampliada.
- Ocular de Ramsden (positivo): Posee dos lentes con un diafragma situado por encima de ellas.
- Ocular de compensación: Diseñado para corregir la aberración cromática en los objetivos apocromáticos. Está compuesto por tres lentes.
- Oculares aplanáticos, ortoscópicos y periscópicos: Mejoran la calidad de la imagen proporcionando un campo visual más amplio.
- Ocular de proyección: Utilizado para proyectar la imagen sobre una pantalla o un sensor digital.
Conclusión
El microscopio óptico es una herramienta fundamental en el estudio de estructuras microscópicas. Su funcionamiento se basa en la combinación de un sistema óptico de lentes, una fuente de iluminación y un soporte mecánico que garantiza su estabilidad. Existen distintos tipos de oculares y objetivos que permiten mejorar la calidad de la imagen y adaptar el microscopio a diferentes necesidades de observación.
Objetivos del Microscopio
Los objetivos son las lentes ubicadas cerca de la muestra y su función principal es ampliar la imagen captada. Dependiendo de la distancia focal, se pueden encontrar diferentes tipos de aumentos como 10x, 20x, 40x y 100x. La magnificación total de una imagen se obtiene multiplicando el aumento del ocular por el del objetivo. Por ejemplo, si se utiliza un ocular de 10x junto con un objetivo de 100x, el objeto observado se verá ampliado 1.000 veces.
Tipos de Objetivos
- Secos: No requieren ningún medio adicional entre la muestra y el objetivo, ya que la separación entre ellos es el aire.
- De inmersión: Se utiliza un líquido de alto índice de refracción (como aceite de cedro, agua o glicerina) entre el objetivo y la muestra para mejorar la resolución.
Los objetivos se fijan al revólver, un componente que permite intercambiarlos según la necesidad. Para identificar rápidamente el aumento de un objetivo, se emplea un código de colores en forma de anillo:
- Negro → 1x
- Castaño → 2x
- Rojo → 4x, 5x
- Amarillo → 10x
- Verde → 20x
- Azul claro → 40x, 50x
- Azul → 60x
- Blanco → 100x (objetivo de inmersión en aceite)
Además, algunos objetivos están diseñados para funciones específicas:
- Objetivos de fluorescencia: Identificados con un anillo anaranjado, utilizan glicerina como líquido de inmersión.
- Objetivos de contraste de fases: Se marcan con las siglas DL, DM y BM.
- Objetivos de contraste diferencial de interferencia (DIC): Permiten mejorar la observación de estructuras internas.
- Objetivos sin cubreobjetos (NCG): Diseñados para muestras sin lámina de protección.
- Objetivos de fluorescencia UV: Marcados con UV-V.
Condensador: Control de la Iluminación
El condensador es un componente óptico que concentra la luz sobre la muestra, mejorando la calidad de la imagen. Su posición puede ajustarse en función del aumento utilizado:
- Para aumentos altos, es recomendable colocarlo lo más arriba posible.
- Para aumentos bajos, es preferible bajarlo para evitar un exceso de luz.
Componentes del Condensador
- Diafragma de Apertura: Regula la cantidad de luz que entra en la muestra, afectando la resolución, el contraste y la profundidad de foco.
- Si se cierra parcialmente, el contraste mejora, pero la resolución disminuye.
- Si se cierra demasiado, pueden aparecer bordes oscuros en la imagen.
- Diafragma de Campo: Define el área iluminada de la muestra y contribuye a la formación de una imagen uniforme.
Uso de Filtros
Dependiendo de la observación a realizar, se pueden intercalar filtros de distintos colores entre la fuente de luz y la muestra. Estos filtros se colocan en un anillo llamado portafiltros y permiten resaltar detalles específicos de la muestra.
Microscopía Digital y Avances Tecnológicos
Gracias a los avances en informática y electrónica, el microscopio ha evolucionado incorporando accesorios como cámaras de alta resolución, monitores y sistemas de impresión de imágenes. Estos dispositivos permiten capturar, almacenar y analizar imágenes microscópicas con mayor precisión.
Dato Clave
El aumento en un microscopio óptico se logra combinando el objetivo y el ocular.
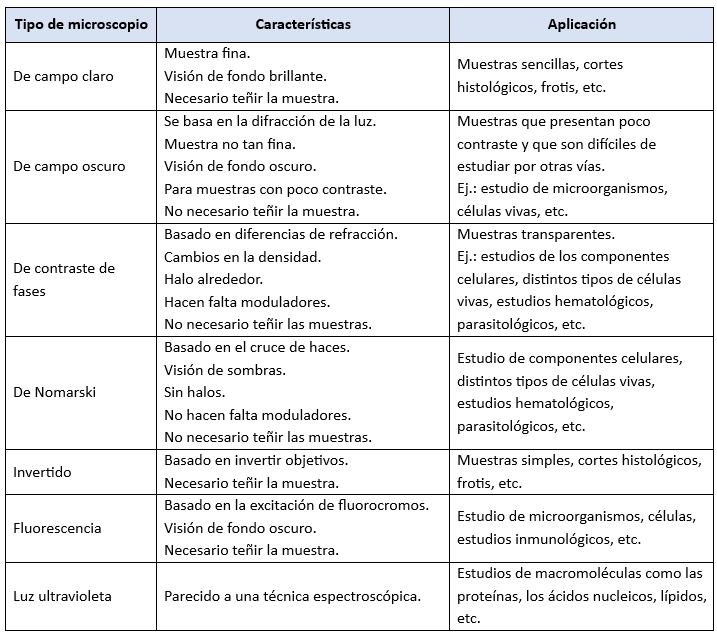
Tipos de Microscopios Ópticos de Luz Transmitida
Los microscopios de luz transmitida funcionan permitiendo que la luz atraviese directamente la muestra. Dependiendo del tipo de iluminación y la técnica utilizada, se pueden clasificar en diferentes tipos.
A) Microscopio de Campo Claro
Es el tipo de microscopio más común y el que hemos descrito hasta ahora. La imagen se forma debido a la opacidad de la muestra, que absorbe parte de la luz. Sin embargo, si el espécimen es demasiado transparente, puede resultar difícil distinguir sus estructuras.
Mejoras en la Observación
Para aumentar la visibilidad de muestras transparentes, se emplean diferentes métodos:
- Tinción: Aplicación de colorantes específicos para resaltar estructuras celulares.
- Técnicas de contraste: Cuando la tinción no es adecuada (por ejemplo, en muestras de microorganismos vivos), se pueden utilizar microscopios de campo oscuro, fluorescencia, polarización o contraste de fases para mejorar la visualización.
B) Microscopio de Campo Oscuro
Este tipo de microscopio se utiliza principalmente para observar microorganismos sin teñir en suspensión líquida. La técnica genera un fondo oscuro, mientras que las partículas aparecen brillantes, resaltando sus formas y movimientos.
Diferencia con el Campo Claro
A diferencia del microscopio de campo claro, este sistema modifica el condensador, evitando que la luz incida directamente sobre la muestra. En su lugar, la luz se desvía en ángulos oblicuos, haciendo que solo los rayos difractados ingresen en el objetivo.
Si la muestra no tiene partículas con diferentes índices de refracción, la imagen aparecerá completamente oscura. Sin embargo, si hay estructuras como bacterias, estas se verán iluminadas sobre el fondo oscuro.
Aplicaciones del Campo Oscuro
- No permite obtener detalles morfológicos precisos, pero ayuda a detectar la presencia de microorganismos y analizar su movilidad.
- Es especialmente útil para la observación de espiroquetas en muestras sin teñir.
Dato Clave
Los microscopios equipados con condensadores de campo oscuro son ideales para analizar preparaciones húmedas y muestras sin teñir, ya que permiten observar microorganismos vivos sin alterar su estructura.
C) Microscopio de Contraste de Fases
Como se mencionó anteriormente, las distintas estructuras de una muestra pueden presentar variaciones en su índice de refracción, lo que provoca diferencias en la forma en que la luz se comporta al atravesarlas. Este microscopio utiliza un sistema especial de condensador y objetivos que permiten resaltar esas diferencias de fase en la luz.
Una parte de la luz incide directamente sobre la muestra de forma perpendicular, mientras que otra parte se dispersa debido a la difracción. Mediante un diafragma anular ubicado antes del condensador, se consigue que estos dos tipos de luz penetren en el objetivo de manera separada y con distinta fase. Esta diferencia de fase genera interferencias, lo que hace que las estructuras de la muestra se visualicen con distintos niveles de brillo, resaltando sus detalles internos.
Este tipo de microscopía es especialmente útil en el estudio de la estructura interna de microorganismos y se utiliza en preparaciones húmedas o en la técnica de gota pendiente.
Dato Curioso
El microscopio de contraste de fases permite detectar estructuras que, de otro modo, serían invisibles con técnicas convencionales. Funciona al modificar la forma en que una parte del haz luminoso es procesado en comparación con el resto, generando un contraste elevado sin necesidad de tinción.
D) Microscopio de Contraste de Interferencia
También conocido como microscopio de Nomarski, este sistema óptico separa el haz de luz en dos direcciones diferentes antes de que atraviesen la muestra. Una vez que ambos haces llegan al objetivo, se combinan nuevamente, generando una imagen con apariencia tridimensional y sombras bien definidas.
A diferencia del microscopio de contraste de fases, este método evita la aparición de halos en la imagen, proporcionando una visualización más nítida de las estructuras.
Principales Características
- Utiliza un filtro polarizador, que genera un haz de luz perpendicular al que proviene del condensador.
- La luz atraviesa la muestra y se desvía en distintas direcciones debido a la interacción con las estructuras presentes.
- No requiere anillos de fase ni diafragmas moduladores, solo el polarizador y un prisma para generar la imagen final.
Este tipo de microscopía es ideal para la observación de muestras sin teñir y para estudiar materiales en estado natural sin necesidad de colorantes.
E) Microscopio Invertido
El microscopio invertido tiene la misma función que un microscopio convencional, pero con una diferencia clave: los objetivos están situados debajo de la platina, mientras que la luz proviene desde arriba.
Ventajas y Aplicaciones
- Permite analizar muestras situadas en el fondo de recipientes como placas de Petri o frascos, lo que facilita el estudio de cultivos celulares sin necesidad de manipularlos.
- Se emplea en el control de monocapas celulares en laboratorios de investigación biomédica.
- Es útil para la observación de cultivos bacterianos utilizando la técnica de gota pendiente, donde una gota de muestra se mantiene en suspensión en un portaobjetos especial con un orificio.
Características Principales
- Al observar la muestra desde debajo de la platina, se pueden analizar células y microorganismos sin alterar su entorno, lo que lo hace ideal para estudios en condiciones naturales.
- Su diseño y funcionalidad lo convierten en una herramienta costosa, debido a la complejidad de su construcción.
Dato Curioso
Aunque en un principio se diseñó para aplicaciones en microquímica, el microscopio invertido ha ganado gran popularidad en diversos campos, como:
- Virología
- Fertilización in vitro
- Estudios de líquidos amnióticos
- Investigación en ingeniería genética
- Observación de muestras gruesas en condiciones estériles
Este microscopio puede utilizar diferentes técnicas de iluminación, como campo claro, contraste de fases y contraste diferencial de interferencia (DIC), lo que permite visualizar materiales sin teñir, resaltando sus detalles mediante variaciones en el contraste y el color.
Microscopios Ópticos de Luz Reflejada
Este tipo de microscopios funcionan a partir de la absorción y emisión de radiación por parte de las muestras analizadas. Entre ellos, el más utilizado es el microscopio de fluorescencia o epifluorescencia.
A) Microscopio de Fluorescencia
La fluorescencia es la propiedad de ciertos materiales de emitir luz de una longitud de onda mayor tras haber sido expuestos a radiaciones de onda corta, como la luz ultravioleta (UV). Cuando una muestra fluorescente es iluminada con radiación UV, aparece como un objeto brillante sobre un fondo oscuro.
El nivel de fluorescencia que se observa es proporcional a la intensidad de la luz incidente. Por ello, el microscopio de fluorescencia cuenta con una lámpara de alta intensidad y un filtro especial para la radiación UV. La luz atraviesa la preparación y, si esta contiene sustancias fluorescentes, emite una señal visible que puede ser observada.
Tipos de Microscopía de Fluorescencia
- Fluorescencia primaria: Ocurre cuando la propia muestra posee compuestos fluorescentes naturales.
- Fluorescencia secundaria: Se observa cuando la muestra ha sido tratada con colorantes fluorescentes.
- Inmunofluorescencia: Se utiliza para la detección de interacciones entre anticuerpos y antígenos. En este caso, los anticuerpos se marcan con sustancias fluorescentes para identificar la presencia de ciertos antígenos.
Sustancias Fluorescentes Comunes en Microscopía
- Auramina: Se emplea para teñir el bacilo de la tuberculosis. Bajo luz UV, emite fluorescencia, facilitando su detección.
- Naranja de acridina: Compuesto utilizado en la tinción de ácidos nucleicos.
- Fluoresceína y Rodamina: Se combinan con anticuerpos para detectar antígenos específicos.
Aplicaciones
El microscopio de fluorescencia se usa principalmente en técnicas de inmunofluorescencia, fundamentales en estudios de diagnóstico y en la investigación de enfermedades infecciosas y autoinmunes.
Componentes Claves de un Microscopio de Fluorescencia
- Fuente de luz: Emite radiación en un rango de longitudes de onda que abarca desde el ultravioleta hasta el infrarrojo.
- Filtro de excitación: Selecciona la banda específica de radiación que incidirá sobre la muestra.
- Muestra fluorescente: Puede ser natural o marcada con fluorocromos.
- Filtro de barrera: Permite el paso solo de la luz fluorescente emitida por la muestra, bloqueando la luz de excitación.
B) Microscopio de Luz Ultravioleta
Este sistema de microscopía funciona mediante la absorción y posterior emisión de radiación ultravioleta por parte de la muestra. Como la luz UV no es visible para el ojo humano y puede ser dañina, la imagen no se observa directamente a través del ocular, sino que es capturada con detectores especiales y luego proyectada en una pantalla o registrada en una fotografía.
Características Principales
- La resolución de un microscopio depende de la longitud de onda utilizada; al emplear radiación UV, que tiene una longitud de onda más corta que la luz visible, se obtiene una resolución mejorada.
- Muchas sustancias biológicas presentan bandas de absorción en el espectro ultravioleta, lo que permite su observación sin necesidad de tinción.
Aplicaciones
Este tipo de microscopio se emplea en biología molecular y bioquímica para la detección de proteínas y ácidos nucleicos, ya que muchas de estas estructuras absorben luz UV de manera natural. También se utiliza en microscopía de fluorescencia para mejorar la resolución de las imágenes.
C) Microscopio Polarizante
En esta técnica, un polarizador se coloca detrás del condensador para modificar la forma en que la luz incide sobre la muestra. La luz transmitida se restringe a un solo plano de vibración, lo que permite observar ciertas estructuras que serían invisibles en condiciones normales.
Aplicaciones
Se utiliza en geología y mineralogía, ya que los cristales y algunas biomoléculas presentan propiedades ópticas anisotrópicas, lo que significa que pueden cambiar la dirección de la luz cuando se observan bajo este microscopio. También es útil en estudios de colágeno y estructuras fibrosas.
D) Microscopio de Barrido de Sonda (SPM – Scanning Probe Microscopy)
Este tipo de microscopio utiliza una sonda ultrafina para recorrer la superficie de la muestra, generando una imagen detallada de su estructura a escala nanométrica.
Principio de Funcionamiento
- En lugar de utilizar luz o electrones, este microscopio emplea una sonda extremadamente pequeña que se mueve sobre la superficie de la muestra.
- La interacción entre la sonda y la muestra genera datos que luego son interpretados para reconstruir la imagen.
- Se obtienen resoluciones extremadamente altas, del orden de 10 nanómetros o menos.
Historia y Aplicaciones
La microscopía de sonda de barrido se desarrolló con la invención del microscopio de efecto túnel (STM) en 1981. Desde entonces, se ha convertido en una herramienta esencial en la nanotecnología, permitiendo estudiar estructuras a nivel atómico.
Este tipo de microscopio se emplea en áreas como:
- Investigación en materiales
- Electrónica y semiconductores
- Nanotecnología y biomedicina
Resumen de los Microscopios Ópticos de Luz Reflejada
| Tipo de Microscopio | Principio de Funcionamiento | Aplicaciones |
|---|---|---|
| Fluorescencia | Emisión de luz de mayor longitud de onda tras irradiación con UV | Diagnóstico clínico, inmunología, microbiología |
| Luz Ultravioleta | Absorción y emisión de radiación UV para mejorar resolución | Detección de proteínas y ácidos nucleicos, investigación biológica |
| Polarizante | Uso de luz polarizada para analizar estructuras anisotrópicas | Geología, mineralogía, biomedicina |
| Barrido de Sonda (SPM) | Uso de una sonda para recorrer la superficie y generar una imagen | Nanotecnología, materiales, electrónica |
Estos microscopios han revolucionado la forma en que se estudian muestras biológicas y materiales, ofreciendo detalles estructurales con un alto nivel de precisión.
Reglas Generales para el Uso del Microscopio
A) Enfoque del Microscopio
Para lograr una observación clara y precisa con el microscopio, es fundamental seguir una serie de pasos:
- Ajustar la posición para sentarse cómodamente a la altura adecuada.
- Seleccionar inicialmente el objetivo de menor aumento.
- Colocar la muestra en la platina y centrarla correctamente. Si la muestra tiene poca estructura visible, se recomienda enfocar en el borde del cubreobjetos.
- Encender la fuente de luz y regular la intensidad con el condensador y el diafragma.
- Acercar lentamente el tubo del microscopio hacia la preparación, evitando el contacto con la muestra.
- Mirar a través del ocular y ajustar el tornillo macrométrico de manera progresiva hasta que la imagen empiece a aparecer. Si no se logra visualizar nada, repetir el procedimiento.
- Una vez obtenida la imagen, refinar el enfoque utilizando el tornillo micrométrico.
- Para cambiar de aumento, girar el revólver y seleccionar un objetivo de mayor potencia, siguiendo un orden progresivo.
- Desplazar la platina para recorrer toda la muestra y explorar diferentes áreas de la preparación.
Enfoque con Objetivo de Inmersión
Para el uso de objetivos de inmersión (como el 100x), se requiere un procedimiento específico:
- Ajustar la postura para trabajar cómodamente.
- Iniciar con un objetivo de menor aumento para localizar la muestra.
- Colocar la preparación en la platina y centrarla correctamente.
- Encender la fuente de luz y regular la intensidad con el condensador y el diafragma.
- Aplicar una gota de aceite de inmersión sobre la preparación.
- Posicionar el objetivo de inmersión en contacto con la gota de aceite.
- Mirar a través del ocular y ajustar el tornillo macrométrico lentamente hasta que la imagen se haga visible.
- Refinar el enfoque con el tornillo micrométrico para obtener una imagen clara.
- Mover la platina para observar toda la muestra sin alterar la posición del aceite.
B) Limpieza de las Partes Ópticas
Si al observar la muestra el campo visual aparece borroso o presenta manchas, es posible que el problema se deba a lo siguiente:
- El portaobjetos está sucio: Se recomienda limpiar la superficie con un paño de microfibra o papel especial para lentes.
- El objetivo tiene residuos de aceite: Si se usa un objetivo de inmersión, es importante limpiarlo con papel especial para lentes. No se aconseja el uso frecuente de disolventes como el xilol, ya que pueden dañar la fijación de la lente.
- Los oculares están sucios: Se pueden limpiar con un soplador de aire o un paño especial.
- La lente del condensador está sucia: Si al girar el ocular las manchas se mueven, es probable que el problema esté en esta lente. Se puede limpiar con aire seco utilizando una pera de caucho y, si es necesario, con un paño especial para lentes.
C) Artefactos Técnicos que Pueden Afectar el Diagnóstico
Los artefactos técnicos son alteraciones que pueden generarse durante la preparación de las muestras y que pueden interferir en el análisis. Algunas de las alteraciones más comunes incluyen:
- Filamentos aislados de cromatina, vacuolización nuclear y restos celulares: Generalmente aparecen por aplastamiento o daño mecánico durante la preparación.
- Zonas con diferencias de conservación celular: Algunas áreas pueden verse bien definidas, mientras que otras presentan células pálidas o con cambios en la proporción núcleo-citoplasma. Este fenómeno ocurre por compresión excesiva de la muestra.
- Manchas pardas con patrón reticulado: Pueden ser consecuencia de un error en la fijación de la muestra.
- Esférulas azules: Se observan en citologías ginecológicas y pueden estar asociadas a la presencia de Trichomonas o a un problema en la filtración de la hematoxilina.
- Pseudonúcleos: Se encuentran en muestras con inflamación o atrofia y pueden deberse a la presencia de mucosidad o material cromatínico condensado.
- Partículas amarillas, marrones o negras (“polvo dorado”): Estas inclusiones pueden simular alteraciones en el citoplasma o en el núcleo. Generalmente, son causadas por la desecación de la muestra antes de aplicar el medio de montaje.
- Gotas de líquido: Ocurren cuando hay una mezcla accidental de xileno y agua en la preparación.
D) Uso del Microscopio en el Diagnóstico de Enfermedades Infecciosas
El microscopio desempeña un papel fundamental en la identificación de agentes infecciosos a través de tres fases principales:
- Observación directa de muestras: Permite detectar la presencia de microorganismos en fluidos corporales, tejidos o secreciones del paciente.
- Cultivo de microorganismos: Se utilizan medios de cultivo para favorecer el crecimiento de patógenos específicos.
- Identificación de microorganismos cultivados: Se analizan características morfológicas, bioquímicas y de sensibilidad a tratamientos antimicrobianos.
La microscopia es la herramienta más utilizada en la detección de microorganismos en muestras clínicas, ya sea a través de la observación directa o mediante el análisis de cultivos.
Procesamiento de Muestras en Microscopía
El método de preparación de la muestra dependerá de su tipo y origen dentro del cuerpo. En cualquier caso, una fracción de la muestra se reserva para su análisis microscópico.
El uso de tinciones específicas facilita la identificación de microorganismos y estructuras celulares. Combinadas con técnicas de microscopía adecuadas, estas tinciones permiten la detección rápida y precisa de los agentes causantes de infecciones.
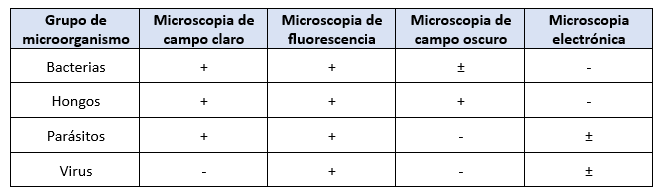
Selección del Tipo de Microscopio Según el Microorganismo a Estudiar
El tipo de microscopio a utilizar depende del microorganismo que se desea identificar:
- Microscopio de campo claro: Ideal para muestras teñidas con colorantes convencionales como la tinción de Gram o la tinción de Ziehl-Neelsen (tuberculosis).
- Microscopio de contraste de fases: Permite visualizar microorganismos en estado vivo sin necesidad de teñirlos.
- Microscopio de fluorescencia: Utilizado en inmunofluorescencia para la detección de virus y bacterias como Mycobacterium tuberculosis.
- Microscopio de campo oscuro: Especialmente útil en la observación de espiroquetas, como Treponema pallidum (sífilis).
Conclusión
El correcto manejo del microscopio es fundamental para obtener imágenes nítidas y realizar diagnósticos precisos. La técnica de enfoque, la limpieza adecuada de los componentes ópticos y el reconocimiento de artefactos técnicos son aspectos clave en su uso.
Además, la microscopía sigue siendo una de las herramientas más valiosas en la detección de enfermedades infecciosas, permitiendo identificar rápidamente microorganismos en muestras clínicas y optimizar los procesos de diagnóstico y tratamiento.
2.2. Concepto, Descripción y Funcionamiento del Microscopio Electrónico de Transmisión
Microscopía Electrónica
En esta área se procesan biopsias que serán analizadas mediante microscopía electrónica. Para estudiar una muestra con este método, es necesario seguir una serie de pasos previos que incluyen la preparación de cortes, su fijación, la inclusión en resinas y la obtención de cortes ultrafinos a través de ultramicrotomía.
Microscopio Electrónico
A diferencia del microscopio óptico, cuya resolución está limitada por la longitud de onda de la luz visible, el microscopio electrónico utiliza electrones en lugar de luz para generar imágenes con una resolución mucho mayor, llegando a niveles nanométricos.
En la década de 1920, se descubrió que los campos electromagnéticos podían funcionar como lentes, dirigiendo y enfocando haces de electrones de manera similar a cómo lo hacen las lentes ópticas con la luz. A medida que aumenta el voltaje aplicado a los electrones, su longitud de onda disminuye, permitiendo una resolución más alta que la que se puede alcanzar con luz visible.
El primer microscopio electrónico fue desarrollado por Knoll y Ruska en Alemania, y más tarde, en 1932, científicos en Norteamérica (Prebus, Hillier y Burton) avanzaron en su desarrollo, haciendo posible su comercialización. A partir de 1950, este tipo de microscopios permitió el estudio detallado de cortes de tejido.
Concepto Clave
El poder de resolución es la distancia mínima entre dos puntos que pueden distinguirse como entidades separadas bajo el microscopio.
Fundamento del Microscopio Electrónico
La microscopía electrónica permite visualizar estructuras biológicas con una precisión extremadamente alta. La imagen se genera a partir de la dispersión de electrones, que varía según el espesor, la densidad molecular y el número atómico del material analizado.
Además, la interacción de los electrones con la muestra puede producir:
- Electrones secundarios, que pueden ser detectados para obtener información sobre la topografía de la muestra.
- Fluorescencia de rayos X, que puede ser utilizada para determinar la composición elemental de los materiales.
Componentes Principales del Microscopio Electrónico
- Fuente de Iluminación
- Genera un haz de electrones a partir de un cátodo luminiscente.
- Los electrones emitidos chocan contra la muestra, generando la imagen.
- Lentes Magnéticas
- Son campos magnéticos que dirigen y enfocan el haz de electrones, cumpliendo la función de las lentes en los microscopios ópticos.
- Sistema de Vacío
- Evita la dispersión de los electrones debido a la presencia de moléculas de aire, lo que es esencial para obtener imágenes nítidas.
- Sistema de Registro de Imagen
- Captura la imagen resultante para su análisis posterior.
Preparación de Muestras para Microscopía Electrónica
Dado que los elementos biológicos están compuestos por átomos de bajo número atómico, no generan imágenes bien definidas de manera natural. Para mejorar la calidad de las imágenes, se emplean diferentes técnicas:
- Contraste con metales pesados
- Se aplican metales como osmio, uranio y oro, los cuales tienen un mayor número atómico y dispersan mejor los electrones.
- Coloración negativa
- La muestra se recubre con un material denso, como el fosfotungstato, que proporciona mayor contraste y facilita la observación de estructuras.
Resolución del Microscopio Electrónico
El microscopio electrónico tiene un poder de resolución mucho mayor que el microscopio óptico. La resolución mejora con:
- Un mayor voltaje de aceleración de los electrones.
- Una mayor velocidad de los electrones.
Este tipo de microscopio puede alcanzar hasta 200.000 aumentos y una resolución inferior a 10 ángstroms (Å).
Limitaciones
- Cualquier partícula o impureza en el aire puede interferir con la trayectoria de los electrones, por lo que las muestras deben analizarse en tubos de vacío.
- Las muestras deben ser ultrafinas y tratadas con sustancias que permitan una mejor dispersión de los electrones.
Tipos de Microscopía Electrónica
Existen cuatro tipos principales de microscopía electrónica:
- Microscopía Electrónica de Transmisión (TEM)
- Permite observar estructuras internas de las muestras.
- Se basa en la transmisión de electrones a través de la muestra, que debe ser extremadamente delgada para permitir el paso del haz de electrones.
- Microscopía Electrónica de Barrido (MEB)
- Se utiliza para analizar superficies con gran detalle.
- En lugar de atravesar la muestra, los electrones se reflejan en su superficie y generan una imagen tridimensional.
- Microscopía Electrónica de Barrido y Transmisión (STEM)
- Combina elementos de la TEM y la MEB.
- Se utiliza para obtener imágenes de alta resolución de estructuras internas y superficiales al mismo tiempo.
- Microscopía Electrónica Confocal
- Utiliza un sistema de barrido para obtener imágenes de alta resolución a diferentes profundidades de la muestra.
- Se aplica en el estudio tridimensional de estructuras biológicas y materiales.
Comparación con la Microscopía Óptica
| Característica | Microscopía Óptica | Microscopía Electrónica |
|---|---|---|
| Fuente de Iluminación | Luz visible | Haz de electrones |
| Resolución | 0.2 µm (200 nm) | 0.001 µm (1 nm) |
| Poder de Aumento | Hasta 1.500x | Hasta 200.000x |
| Medio de Trabajo | Aire | Vacío |
| Preparación de Muestras | Relativamente sencilla | Muestras ultrafinas, con contrastes de metales pesados |
| Observación de Virus | No es posible | Sí es posible |
Resumen y Conclusión
- El microscopio electrónico supera ampliamente la resolución del microscopio óptico, permitiendo la observación de estructuras subcelulares con una precisión nanométrica.
- Funciona con un haz de electrones, dirigido por lentes magnéticas, y necesita un sistema de vacío para evitar interferencias.
- Para mejorar la imagen, las muestras deben tratarse con metales pesados o colorantes negativos.
- Existen distintos tipos de microscopía electrónica, cada uno diseñado para aplicaciones específicas.
La microscopía electrónica ha revolucionado el estudio de la biología celular, la virología y la nanotecnología, permitiendo el análisis detallado de estructuras que no pueden ser vistas con otros métodos.
Microscopio Electrónico de Transmisión (TEM)
Fundamento
El microscopio electrónico de transmisión (TEM) recibe su nombre porque su funcionamiento se basa en la transmisión de un haz de electrones a través de la muestra que se desea observar.
Su principio de operación es similar al de un microscopio óptico, pero en lugar de utilizar luz visible, emplea un haz de electrones dirigido por lentes electromagnéticas, que permiten obtener imágenes con una resolución mucho mayor.
El TEM se basa en la interacción de los electrones con la muestra:
- Al atravesarla, algunos electrones son absorbidos o desviados, dependiendo de la densidad y composición del material.
- Los electrones que emergen forman una imagen al interactuar con una pantalla fluorescente, similar a la de un televisor.
- La imagen obtenida puede ser capturada mediante una cámara fotográfica o un sistema digital para su análisis.
La fuente de electrones generalmente es un filamento de tungsteno, sometido a un voltaje que varía entre 30 y 150 kV.
Proceso de Formación de la Imagen
- Generación del haz de electrones:
- Un filamento de tungsteno emite electrones cuando se calienta en un entorno de vacío.
- Aceleración de los electrones:
- Se aplica una diferencia de potencial para que los electrones se desplacen a alta velocidad.
- Enfoque del haz:
- Mediante un condensador electromagnético, los electrones son dirigidos hacia la muestra.
- Interacción con la muestra:
- Los electrones atraviesan la muestra y su intensidad varía dependiendo de la densidad del material.
- Formación de la imagen:
- Los electrones emergentes son capturados por lentes de proyección y dirigidos a una pantalla fluorescente donde se forma la imagen.
Requisitos de la Muestra para el TEM
Para obtener imágenes de calidad en un TEM, la muestra debe cumplir con ciertos requisitos:
- Ser extremadamente delgada para permitir el paso de los electrones.
- Estar libre de impurezas que puedan desviar el haz de electrones, como átomos pesados (hierro o plomo).
- Ser estable y resistente a la manipulación y al vacío, evitando que se volatilice bajo la exposición a los electrones.
Debido a que los electrones no pueden desplazarse libremente en presencia de aire, el interior del microscopio se mantiene en vacío, lo que impide la observación de microorganismos vivos y el estudio de procesos biológicos en tiempo real.
Técnicas de Preparación de Muestras
Para preparar una muestra adecuadamente en un TEM, se pueden utilizar diversas técnicas:
- Tinción negativa
- Se rodea la muestra con una sustancia densa en electrones, lo que permite visualizar su contorno con gran detalle.
- Microtomía
- Se obtienen cortes ultrafinos de la muestra utilizando un ultramicrotomo, asegurando que sean lo suficientemente delgados para ser atravesados por los electrones.
- Congelación rápida
- Se congela la muestra a temperaturas extremadamente bajas para preservar su estructura sin necesidad de fijadores químicos.
Partes del Microscopio Electrónico de Transmisión
El TEM está compuesto por varios elementos esenciales para su funcionamiento:
1. Tubo del Microscopio
- Es la estructura principal que alberga todos los componentes del sistema.
- Mantiene el alto voltaje necesario para la aceleración de los electrones.
2. Fuente de Electrones
- Se encuentra en la parte superior del tubo.
- Consiste en un filamento de tungsteno o lantano que, al calentarse en un entorno de vacío, libera electrones (funcionando como cátodo).
3. Ánodo
- Ubicado frente al cátodo.
- Se aplica un diferencial de voltaje entre el ánodo y el cátodo para acelerar los electrones.
4. Condensador Electromagnético
- Se encarga de enfocar el haz de electrones en dirección a la muestra.
5. Lentes Objetivo y de Proyección
- Modifican y enfocan el haz de electrones a través de una pequeña abertura antes de llegar a la pantalla de visualización.
6. Brazo Porta-Muestras
- Se trata de un sistema articulado que permite insertar y extraer la muestra sin comprometer el vacío del microscopio.
7. Pantalla Fluorescente
- Superficie recubierta con cristales de fósforo.
- Al ser bombardeada por los electrones, emite luz visible y genera la imagen.
8. Sistemas Auxiliares
- Transformador: Regula la energía del microscopio.
- Bombas de vacío: Mantienen el interior libre de aire para evitar la dispersión de los electrones.
- Cámara fotográfica o digital: Captura la imagen proyectada para su análisis posterior.
Resumen del Microscopio Electrónico de Transmisión (TEM)
| Característica | Descripción |
|---|---|
| Fuente de iluminación | Haz de electrones generado por un filamento de tungsteno |
| Medio de trabajo | Vacío |
| Lentes | Lentes electromagnéticas en lugar de lentes ópticas |
| Proceso de imagen | Los electrones atraviesan la muestra y son capturados en una pantalla fluorescente |
| Requisitos de la muestra | Debe ser ultrafina, libre de impurezas y resistente al vacío |
| Técnicas de preparación | Tinción negativa, microtomía y congelación rápida |
| Resolución | Mayor que la de un microscopio óptico, alcanzando detalles nanométricos |
Conclusión
El microscopio electrónico de transmisión (TEM) es una herramienta avanzada que permite estudiar estructuras celulares y moleculares con una resolución inigualable.
- Funciona con un haz de electrones que atraviesa la muestra y genera una imagen en una pantalla fluorescente.
- La preparación de la muestra es compleja, ya que debe ser ultrafina, libre de impurezas y estable en condiciones de vacío.
- Permite obtener imágenes con un detalle nanométrico, mucho más preciso que los microscopios ópticos convencionales.
El TEM ha sido fundamental en el estudio de la biología celular, la virología y la nanotecnología, proporcionando imágenes de estructuras invisibles para otros tipos de microscopios.
Funcionamiento del Microscopio Electrónico de Transmisión (TEM)
El microscopio electrónico de transmisión (TEM) genera un haz de electrones mediante un filamento de tungsteno, el cual es sometido a una corriente eléctrica de alto voltaje.
Este filamento emite electrones de forma continua desde la corteza de sus átomos, gracias a la energía proporcionada por un transformador, que incrementa la tensión desde 220 voltios hasta valores entre 200.000 y 600.000 voltios. Para que el haz pueda desplazarse sin interferencias, el interior del microscopio debe mantenerse en vacío.
Propiedades de los Electrones y su Interacción con la Muestra
Los electrones poseen ciertas características que influyen en su comportamiento dentro del microscopio:
- Tienen carga negativa, lo que permite que puedan ser acelerados con una diferencia de potencial y dirigidos mediante lentes electromagnéticas.
- Poseen una masa muy pequeña y un poder de penetración limitado, lo que impide que atraviesen materiales de más de 10 nanómetros de espesor.
- Son fácilmente desviados por partículas de aire, por lo que el microscopio opera en condiciones de vacío.
La muestra observada en el TEM suele estar tratada con compuestos de osmio y plomo, los cuales aumentan el contraste y mejoran la visualización de los detalles estructurales.
Cuando los electrones atraviesan la muestra:
- Las zonas de mayor densidad retienen más electrones, generando sombras.
- Las áreas menos densas permiten el paso del haz, proyectando una imagen en la pantalla fluorescente.
- Esta pantalla está recubierta con un material fosforescente que emite luz visible al ser impactado por los electrones.
Para mejorar la calidad de la imagen y su posterior análisis, se capturan fotografías en blanco y negro.
El TEM permite obtener altos aumentos, gracias al uso de lentes electromagnéticas, que concentran y amplifican el haz de electrones en un punto específico.
Técnicas de Barrido en Microscopía Electrónica
En 1938, Manfred von Arden desarrolló un prototipo de microscopio electrónico de barrido (MEB), basándose en investigaciones previas de Mac Koll. Sin embargo, su comercialización no comenzó hasta la década de 1970.
A diferencia del TEM, en el microscopio de barrido los electrones no atraviesan la muestra, sino que interactúan con su superficie.
Preparación de la Muestra para el MEB
- Fijación de la muestra: Se estabiliza con sustancias químicas para conservar su estructura.
- Deshidratación: Se eliminan los líquidos mediante desecación en punto crítico, evitando alteraciones en la forma de la muestra.
- Recubrimiento con metales: Se aplica una capa fina de oro o carbono para mejorar la conducción de los electrones.
- Montaje en una base de aluminio: La muestra se fija en una plataforma para su análisis.
En el caso de tejidos mineralizados, es posible eliminar los tejidos blandos con soluciones químicas (como lejía), permitiendo un estudio detallado de la estructura mineral.
Formación de la Imagen en el Microscopio Electrónico de Barrido (MEB)
A diferencia del TEM, donde los electrones atraviesan la muestra, en el MEB se genera una imagen tridimensional al analizar la interacción del haz de electrones con la superficie del material.
- Generación del haz de electrones mediante una lente condensadora.
- El haz se mueve en un patrón de barrido (rastro similar al de una pantalla de televisión) gracias a una bobina electromagnética.
- Cada vez que los electrones impactan la superficie de la muestra, se liberan electrones secundarios.
- Un detector recoge estos electrones y los convierte en una señal eléctrica.
- Esta señal se procesa para formar una imagen en una pantalla de televisión.
El barrido sigue un movimiento sincronizado con el punto que genera la imagen en la pantalla, lo que permite reconstruir la imagen con alta precisión.
Las imágenes obtenidas con MEB son más intuitivas de interpretar que las del TEM, ya que presentan un efecto tridimensional que facilita el análisis visual.
Comparación entre TEM y MEB
| Característica | Microscopio Electrónico de Transmisión (TEM) | Microscopio Electrónico de Barrido (MEB) |
|---|---|---|
| Modo de Análisis | Los electrones atraviesan la muestra | Los electrones interactúan con la superficie |
| Tipo de Imagen | Imagen plana en alta resolución | Imagen tridimensional de la superficie |
| Preparación de Muestras | Deben ser ultrafinas (menores de 100 nm) | No es necesario realizar cortes |
| Técnica de Visualización | Se observan detalles internos | Se observan detalles externos |
| Uso Principal | Análisis de estructuras celulares y subcelulares | Estudio de la topografía de la muestra |
| Recubrimiento Metálico | No es necesario | Se aplica una capa fina de oro o platino |
Resumen y Conclusión
- El microscopio electrónico de transmisión (TEM) permite analizar la estructura interna de las muestras a nivel nanométrico.
- El microscopio electrónico de barrido (MEB) se especializa en la visualización tridimensional de superficies.
- Ambos microscopios requieren vacío para evitar la dispersión de los electrones.
- El TEM necesita muestras ultrafinas, mientras que el MEB requiere un recubrimiento metálico.
- La obtención de imágenes en el MEB facilita la interpretación, ya que presenta un efecto tridimensional.
Ambos tipos de microscopía electrónica han revolucionado el estudio de materiales biológicos e industriales, permitiendo la observación de estructuras con una precisión sin precedentes.
Proceso Básico en Microscopía Electrónica
El análisis de muestras en microscopía electrónica requiere un proceso previo de preparación que incluye varias etapas fundamentales: fijación, posfijación, deshidratación, desecación, montaje y recubrimiento.
Fijación de la Muestra
El objetivo de la fijación es detener los procesos de degradación celular que ocurren después de la muerte de la célula, preservando la estructura y composición del tejido de la forma más fiel posible. Para lograrlo, la fijación debe realizarse inmediatamente tras la extracción de la muestra, idealmente dentro del primer minuto.
Esta técnica permite obtener una imagen estática, evitando alteraciones en la estructura de la muestra antes de su análisis.
Fijación Química
Los fijadores químicos actúan bloqueando la autólisis celular mediante la inactivación enzimática, al mismo tiempo que previenen el crecimiento bacteriano.
El fijador más comúnmente utilizado en microscopía electrónica es el glutaraldehído, preparado en una solución tamponada con fosfato a un pH entre 7,2 y 7,4.
Tiempo de Fijación
- Varía entre 2 y 24 horas, dependiendo del tamaño de la muestra.
- Un tiempo promedio de fijación es de 6 horas a una temperatura de 4°C.
Durante este proceso, algunas muestras pueden flotar en la solución fijadora debido a la presencia de agua en sus estructuras. Para evitar esto, se recomienda añadir una pequeña cantidad de tensioactivo, como Tween-80, que reduce la tensión superficial y mejora la penetración del fijador.
Después de la fijación, las muestras se lavan en solución tampón durante aproximadamente 15 minutos.
Propiedades del Glutaraldehído
Este compuesto se utiliza en la fase inicial de fijación, ya que estabiliza proteínas y mucopolisacáridos, permitiendo la conservación de la estructura tisular. Sin embargo, no es efectivo para la fijación de lípidos, lo que puede afectar la preservación de membranas celulares y organelos.
- Se usa en concentraciones entre 2,5% y 5%, en solución tamponada.
- Se mantiene a pH de 7,2 con tampón fosfato o cacodilato.
- El tiempo de fijación varía entre 1 hora y 5 días, pero debe almacenarse a 4°C para preservar su eficacia.
- Para eliminar el exceso de glutaraldehído después de la fijación, se realizan lavados con solución de sacarosa tamponada (pH 7,2).
Posfijación de la Muestra
Una vez finalizada la fijación primaria, se procede a una fijación secundaria con tetróxido de osmio, generalmente en concentración del 2%, en la misma solución tampón utilizada anteriormente.
Esta etapa se realiza a 4°C, en oscuridad, y tiene una duración aproximada de una hora.
Propiedades del Tetróxido de Osmio
Ventajas
- Rápida acción sobre los tejidos, deteniendo la autólisis celular de manera eficiente.
- Aumenta el contraste de la imagen, facilitando la observación bajo el microscopio electrónico.
Desventajas
- Dificultad de penetración en los tejidos: Si la muestra es demasiado gruesa, el fijador solo afectará las regiones superficiales.
- Disminución progresiva de la concentración en el interior de la muestra debido a la absorción del osmio por las capas externas.
Mecanismo de Acción
El tetróxido de osmio provoca un efecto de gelificación en las proteínas, transformándolas en un estado semisólido que estabiliza tanto los medios extracelulares como intracelulares.
Su capacidad de fijar lípidos permite que las membranas celulares se vuelvan más densas en la imagen microscópica, facilitando su observación.
Deshidratación de la Muestra
Una vez finalizado el proceso de fijación, las muestras deben ser deshidratadas para eliminar el agua y permitir su posterior procesamiento.
Para ello, se utilizan disolventes como etanol, acetona o etilenglicol, en concentraciones progresivamente mayores.
Proceso de Deshidratación con Acetona
| Concentración de Acetona | Tiempo de Inmersión |
|---|---|
| 30% | 10 minutos |
| 50% | 10 minutos |
| 70% | 10 minutos |
| 90% | 10 minutos |
| 95% | 10 minutos |
| 100% | 2 cambios de 10 minutos cada uno |
| Acetona anhidra | 2 cambios de 10 minutos cada uno |
| Acetato de amilo | 2 cambios de 10 minutos cada uno |
Este proceso gradual evita la deformación y colapso de las estructuras celulares, asegurando la conservación de los detalles ultraestructurales de la muestra.
Resumen del Proceso de Preparación de Muestras para Microscopía Electrónica
| Etapa | Descripción |
| Fijación | Preserva la estructura celular mediante compuestos químicos como el glutaraldehído. |
| Posfijación | Aumenta el contraste y estabiliza los lípidos con tetróxido de osmio. |
| Lavado | Se eliminan residuos del fijador con solución tampón. |
| Deshidratación | Se reemplaza el agua celular con solventes progresivos para evitar deformaciones. |
Conclusión
El correcto procesamiento de las muestras es esencial para obtener imágenes claras y precisas en microscopía electrónica.
- El glutaraldehído es el fijador principal, preservando proteínas y estructuras celulares.
- El tetróxido de osmio mejora el contraste y permite una mejor visualización de membranas celulares.
- La deshidratación progresiva evita la alteración de la muestra y permite su posterior procesamiento.
Este protocolo garantiza que las muestras estén óptimamente preparadas para su observación con microscopios electrónicos, permitiendo el estudio de estructuras biológicas a nivel nanométrico con gran detalle.
Desecación de las Muestras en Microscopía Electrónica de Barrido (MEB)
Para observar muestras en el microscopio electrónico de barrido (MEB), es esencial eliminar completamente la humedad de la muestra mediante un proceso de desecación. Existen dos métodos principales para lograrlo:
- Secado en estufa
- Se lleva a cabo a 148°C durante 8 minutos en una estufa de vacío.
- Se recomienda para muestras con estructuras resistentes a la deformación.
- Secado por punto crítico
- Se emplea para muestras más frágiles, ya que minimiza la distorsión estructural.
- Se basa en el cambio de fase del líquido al gas sin pasar por una fase intermedia, evitando la tensión superficial que podría alterar la estructura de la muestra.
- Tras la deshidratación con acetato de amilo, la muestra se coloca en una cámara donde se introduce dióxido de carbono líquido (CO₂).
- Se eleva la temperatura hasta alcanzar el punto crítico del CO₂ (31,1°C y 72,9 atm de presión), logrando una transición suave del estado líquido al gaseoso sin daños en la muestra.
Montaje de las Muestras
Una vez secas, las muestras se fijan en portamuestras de aluminio, previamente numerados, mediante pegamento de secado rápido, como la plata coloidal.
Consideraciones durante el montaje:
- La plata coloidal debe mantenerse en estado semilíquido para permitir una correcta adhesión.
- Se debe aplicar la cantidad justa de adhesivo para evitar cubrir zonas de interés en la muestra.
- Se espera a que la plata seque completamente antes de proceder al recubrimiento.
Recubrimiento de las Muestras
Para mejorar la calidad de la imagen en el MEB, las muestras se recubren con una capa conductora que facilita la dispersión de la carga eléctrica y evita la acumulación de calor durante el barrido de electrones.
Se utilizan materiales como:
- Carbón
- Oro
- Platino
- Paladio
Técnicas de recubrimiento más utilizadas:
- Metalización con oro: Se deposita una capa uniforme de oro sobre la muestra.
- Doble metalización: Se aplica primero una capa de carbón y luego otra de oro, mejorando la conductividad y el contraste de la imagen.
Importancia del grosor del recubrimiento:
- Si la capa es demasiado delgada, puede generar efectos de carga, provocando destellos en la pantalla.
- Si la capa es muy gruesa, puede ocultar detalles de la superficie de la muestra.
- Para evitar estos problemas, se utilizan medidores de grosor que garantizan una capa óptima para la observación.
Aplicaciones de la Microscopía Electrónica de Barrido (MEB)
El MEB se emplea en diversas disciplinas científicas para analizar la morfología de las muestras, siempre que estas sean capaces de soportar condiciones de alto vacío.
Áreas de Aplicación:
- Estudio del sistema inmunitario y sanguíneo
- Se pueden identificar poblaciones celulares y establecer patrones morfológicos, lo que ayuda en el diagnóstico de enfermedades como la leucemia.
- Análisis de biomineralización y tejidos duros
- Permite estudiar la formación de estructuras mineralizadas sin necesidad de procesos de descalcificación.
- Investigación en microvasculatura
- Se utiliza para examinar la red vascular de distintos órganos y sistemas biológicos.
- Análisis de composición química mediante técnicas avanzadas
- Se pueden incorporar detectores de rayos X de energía dispersiva (EDS) y electrones retrodispersados, lo que permite:
- Determinar la composición química de la muestra.
- Analizar la distribución de elementos en diferentes regiones de la muestra.
- Se pueden incorporar detectores de rayos X de energía dispersiva (EDS) y electrones retrodispersados, lo que permite:
- Detección de estructuras marcadas con elementos de alto número atómico
- Mediante técnicas como la inmunocitoquímica con oro coloidal, se pueden identificar:
- Enzimas específicas.
- Antígenos y receptores celulares.
- Mediante técnicas como la inmunocitoquímica con oro coloidal, se pueden identificar:
Métodos de Fijación en Microscopía Electrónica
En microscopía electrónica, la fijación de muestras puede realizarse mediante diferentes métodos y soluciones fijadoras:
- Glutaraldehído
- Se emplea en solución tamponada con fosfato o cacodilato, en concentraciones entre 2,5% y 4%.
- Para análisis rutinarios, se recomienda el tampón fosfato.
- Para estudios citoquímicos, se prefiere el tampón de cacodilato, que además tiene propiedades bactericidas.
- Solución de Karnovsky
- Contiene una combinación de paraformaldehído y glutaraldehído.
- Se emplea en protocolos de fijación única.
- Tetróxido de Osmio como fijador único
- Puede utilizarse directamente como fijador, con un tiempo de acción de una hora.
- Fijación doble (glutaraldehído + tetróxido de osmio)
- Paso 1: Se sumerge el tejido en glutaraldehído durante 4 a 16 horas en solución de cacodilato.
- Paso 2: Se realiza un lavado en solución tampón con tres cambios de 5 minutos cada uno.
- Paso 3: Se fija en tetróxido de osmio durante una hora a temperatura ambiente.
- Paso 4: Se lava en agua destilada, con dos cambios.
- Paso 5: Se realiza la inclusión en resina para su posterior observación.
Resumen del Proceso en Microscopía Electrónica de Barrido
| Fase | Descripción |
|---|---|
| Desecación | Se eliminan líquidos mediante secado en estufa o secado por punto crítico. |
| Montaje | Se fijan las muestras en portamuestras de aluminio usando plata coloidal. |
| Recubrimiento | Se aplica una capa conductora de oro, platino o carbono para mejorar la observación. |
| Aplicaciones | Se utiliza en biomedicina, materiales, geología y química para estudiar superficies. |
Conclusión
El MEB es una herramienta fundamental en múltiples áreas científicas, ya que permite analizar la morfología y composición de las muestras con una resolución excepcional.
- El secado por punto crítico es el método más adecuado para muestras frágiles, ya que minimiza la distorsión estructural.
- El recubrimiento con metales mejora la calidad de imagen y evita problemas de carga en la observación.
- El MEB permite estudios avanzados, como el análisis químico mediante rayos X y la identificación de estructuras marcadas con elementos pesados.
Gracias a estas técnicas, la microscopía electrónica de barrido sigue siendo una herramienta clave en la investigación biomédica, nanotecnología y ciencias de los materiales.
Microscopio de Barrido y Transmisión
Este tipo de microscopía combina dos enfoques: microscopía de barrido de sonda y microscopía de transmisión, lo que permite obtener imágenes con un nivel de ampliación capaz de visualizar los átomos de las moléculas que componen la muestra.
Microscopía de Barrido Confocal
La microscopía de barrido confocal es un tipo de microscopía de fluorescencia electrónica, diseñada para mejorar la resolución de las imágenes al enfocarse en un plano específico de la muestra.
Principio de Funcionamiento
- Utiliza un rayo láser para escanear la muestra.
- La luz fluorescente emitida por la muestra es captada por el objetivo y enfocada hacia un fotomultiplicador.
- Solo la luz proveniente del plano focal seleccionado se visualiza con nitidez, eliminando la fluorescencia que proviene de otras capas.
Generación de Imágenes en 3D
- Se obtiene una serie de imágenes de distintos planos de la muestra.
- Un software especializado combina estos planos para generar una imagen en tres dimensiones.
Aplicaciones
Se utiliza en estudios de:
- Proteínas, carbohidratos y lípidos.
- Investigaciones genéticas.
- Análisis de muestras en estado estático o dinámico, permitiendo el seguimiento de procesos biológicos en tiempo real.
Captura y Archivo de Imágenes Digitales
En microscopía electrónica, la imagen obtenida pasa por un proceso de tratamiento antes de su visualización.
Tipos de Imágenes
- Imagen analógica: Representa una señal continua, en forma de ondas.
- Imagen digital: Se forma a partir de pulsos (cuantos) y se compone de datos numéricos.
Captura de Imágenes
La calidad de una imagen depende de cómo se captura. Existen diversos sistemas de captura, entre los más utilizados se encuentran:
- CCD (Charge-Coupled Device)
- Funciona como un fotorreceptor que captura la luz mediante sensores de silicio.
- Convierte la luz en una imagen matricial, ajustando los voltajes para formar la imagen.
- CMOS (Complementary Metal-Oxide Semiconductor)
- Similar al CCD, pero con menor sensibilidad.
- Es más eficiente en términos de consumo energético.
- Fotomultiplicador (PMT)
- Captura la luz incidente y amplifica la señal de electrones.
- Se usa principalmente en microscopía confocal, permitiendo el análisis punto por punto.
Mejora de la Calidad de la Imagen
Para obtener imágenes de alta calidad, es esencial optimizar la captura desde el inicio, ya que el procesamiento posterior tiene limitaciones en la corrección de errores.
Factores Claves en la Captura de Imágenes
- Corrección de Imperfecciones Antes de la Captura
- Un enfoque adecuado es fundamental.
- Tiempo de Exposición
- Un mayor tiempo de exposición mejora la calidad de la imagen, pero en exceso puede generar efectos indeseados.
- Se recomienda realizar la captura manualmente para obtener el mejor resultado.
- Contraste y Resaltado de Detalles
- Es importante definir claramente los detalles que se desean analizar.
- Si no se destacan en la captura, puede ser difícil recuperarlos en el procesamiento.
- Ajuste de la Iluminación
- Se deben seleccionar filtros adecuados para mejorar la calidad de la imagen.
- Control del Fondo y Brillo
- La relación señal/ruido debe ser lo más alta posible, reduciendo interferencias en la imagen.
Optimización Digital de Imágenes
Existen programas informáticos especializados que permiten mejorar la imagen tras la captura, con herramientas como:
- Eliminación del ruido de fondo (background).
- Balance de blancos: Ajusta el contraste y brillo de la imagen.
- Corrección Gamma: Permite modificar la luminosidad de las zonas oscuras, especialmente útil en microscopía de fluorescencia.
Resumen y Conclusión
- La microscopía de barrido y transmisión permite obtener imágenes detalladas de la estructura molecular.
- La microscopía confocal mejora la resolución al capturar distintos planos de la muestra, creando imágenes tridimensionales.
- La calidad de las imágenes en microscopía electrónica depende de la captura inicial, por lo que es fundamental optimizar el enfoque, el contraste y la iluminación.
- Los sistemas de captura (CCD, CMOS, PMT) convierten la luz en imágenes digitales, permitiendo un análisis detallado.
- El procesamiento digital mejora las imágenes capturadas, pero no puede corregir completamente los errores de la captura inicial.
Gracias a estas técnicas, la microscopía electrónica sigue siendo una herramienta esencial en la investigación científica, permitiendo explorar estructuras a nivel molecular y atómico con una precisión sin precedentes.
Almacenamiento de Imágenes
Las imágenes obtenidas en microscopía pueden almacenarse utilizando diferentes métodos gráficos. En un sistema de información binaria, los datos pueden guardarse mediante sistemas vectoriales o en mapas de bits.
- Sistema vectorial: Describe las propiedades de la imagen, incluyendo su forma, ubicación y otros detalles sin perder calidad al ampliar la imagen.
- Sistema de mapa de bits: Representa la imagen mediante una cuadrícula de píxeles (elementos de imagen). A mayor cantidad y menor tamaño de estos cuadros, mayor será la resolución.
Para optimizar el almacenamiento, ambos sistemas pueden combinarse, codificando la imagen en bytes, donde 1 byte equivale a 8 bits.
Formatos de archivo más utilizados en microscopía
- TIFF (Tagged Image File Format): Se usa para imágenes en escala de grises y alta resolución.
- JPG/JPEG (Joint Photographic Experts Group): Permite comprimir imágenes TIFF, reduciendo el tamaño del archivo sin comprometer demasiado la calidad. Se adapta mejor a imágenes en color.
- GIF (Graphics Interchange Format): Es ideal para animaciones y permite almacenar imágenes con un número reducido de colores.
- BMP (Windows Bitmap): Específico para el sistema operativo Windows, funciona bien en blanco y negro o en escala de grises.
Transferencia de Imágenes
Al transferir imágenes, es común comprimir los archivos para reducir su tamaño. Sin embargo, esto puede conllevar pérdida de información.
Para compartir datos de microscopía, una alternativa moderna es el almacenamiento en nubes privadas en la red, donde el usuario puede acceder de forma segura mediante invitaciones o permisos específicos.
Cuando se realiza un estudio microscópico, lo más recomendable es guardar los datos en una memoria externa y recogerlos en persona para garantizar la seguridad y calidad de la información.
Otras Tecnologías en Microscopía
Transmisión de Imágenes Vía Satélite
Gracias a la telepatología, los especialistas pueden analizar muestras a larga distancia. Este avance combina:
- Microscopios controlados por robot.
- Software especializado para análisis remoto.
- Cámaras y monitores de alta definición.
El proceso permite que una preparación colocada en la platina del microscopio sea transmitida en tiempo real a un especialista ubicado en otro lugar. Este profesional puede manipular la imagen como si estuviera observándola directamente en el microscopio.
Este sistema abre la posibilidad de que cualquier parte del mundo tenga acceso a diagnósticos de alta precisión sin necesidad de desplazamientos.
Micromanipulación
Tradicionalmente, la microscopía se ha centrado en la observación de muestras, pero hoy en día es posible también manipularlas a nivel microscópico.
Este avance es crucial en investigaciones biológicas, donde es necesario interactuar con muestras vivas a una escala extremadamente pequeña.
Herramientas principales en micromanipulación:
- Microscopio especializado, que proporciona la visión detallada del objeto de estudio.
- Micromanipulador, que actúa como las “manos” del investigador, permitiendo realizar ajustes precisos en estructuras microscópicas.
Áreas de aplicación:
- Microdisección celular, utilizada en investigaciones biomédicas.
- Ingeniería genética, donde se pueden modificar estructuras celulares con alta precisión.
- Neurología, facilitando la manipulación de células nerviosas para estudios avanzados.
Conclusión
Las nuevas tecnologías han revolucionado la microscopía, permitiendo no solo la observación, sino también la manipulación de muestras y la transmisión remota de imágenes en alta resolución.
- El almacenamiento digital de imágenes permite conservar y compartir datos de forma eficiente.
- La telepatología facilita la colaboración global entre especialistas sin importar la distancia.
- Las técnicas de micromanipulación amplían las aplicaciones de la microscopía en campos como la biomedicina y la genética.
Gracias a estos avances, la microscopía sigue evolucionando como una herramienta fundamental en el diagnóstico y la investigación científica.


