Obtención, Conservación y Transporte de Muestras Biológicas
Concepto de Muestra
En general, se considera material biológico a cualquier material de origen humano o de otras especies relacionadas con la salud humana, ya sea nativo o modificado. Esto incluye excreciones, secreciones, líneas celulares, tejidos, líquidos tisulares (como sangre, plasma, suero, saliva) y aislamientos de microorganismos (cultivos).
La Ley 14/2007 de investigación biomédica define una “muestra biológica” como cualquier material biológico de origen humano que sea susceptible de conservación y que pueda contener información sobre la dotación genética característica de una persona.
Es fundamental que todos los profesionales involucrados en el manejo de muestras biológicas conozcan el procedimiento correcto para evitar errores que puedan resultar en un diagnóstico erróneo.
Las muestras biológicas, que pueden incluir tejido, sangre, orina o cualquier otro producto de excreción, secreción o incluso aire espirado, se utilizan para análisis hematológicos (que examinan los componentes formados de la sangre), bioquímicos (que analizan los componentes químicos de los diferentes líquidos y fluidos corporales como sangre, orina, LCR, etc.), microbiológicos (que detectan la presencia de gérmenes en diversas muestras) e inmunológicos.
Objetivos Generales de las Técnicas de Muestras Biológicas
- Realizar un diagnóstico correcto del proceso patológico.
- Hacer un seguimiento de una enfermedad ya establecida.
- Descartar posibles patologías sospechadas por la presencia de síntomas típicos.
- Realizar estudios de investigación clínica.
- Proporcionar herramientas al médico para prescribir correctamente los fármacos.
Tipos de Muestras Biológicas
Las muestras biológicas pueden ser muy variadas y cada una requiere un proceso específico para su transporte y análisis. Dependiendo del tipo de sustancia a analizar, se deben tomar ciertas precauciones. Los principales tipos de muestras que se pueden obtener son:
Líquidos corporales: Estos son los fluidos en los que se realizan la mayoría de las pruebas y constituyen la base del análisis de laboratorio. Incluyen orina, sangre, líquido cefalorraquídeo (LCR), entre otros, que se encuentran en los espacios transcelular, intracelular o extracelular.
Exudados: Son líquidos liberados por el organismo debido a una patología subyacente, y no son normales. Ejemplos incluyen exudados catarrales, purulentos y serosos.
Tejidos: Se obtienen normalmente ante la sospecha de patologías cancerosas. Estas pequeñas muestras de tejido se obtienen mediante punción o raspado.
Secreciones: Son sustancias que el organismo produce habitualmente para realizar funciones normales como la digestión y la regulación de la temperatura.
Elementos de desecho: Principalmente se refieren a las heces.
Células: Las células pueden obtenerse mediante la realización de un frotis, ya sea sanguíneo o de cualquier mucosa del organismo mediante fricción.
Tipos de Envases para la Toma de Muestras
- Frascos de boca ancha: De plástico con tapa de rosca, permiten recoger las muestras sin manipularlas excesivamente y sin riesgo de contaminación. Se comercializan estériles y hay varias variedades:
- Frascos para urocultivo: Aproximadamente de 150 ml.
- Frascos para heces: Equipados con una cucharilla para la recolección.
- Frascos para esputo: De unos 30 ml de capacidad, que pueden sustituirse por una placa de Petri.
- Frascos de boca estrecha: Para muestras cuya recolección es menos dificultosa, reduciendo la posibilidad de contaminación.
- Frascos de llenado por vacío: Minimizan el contacto con la muestra. Son tubos con vacío en su interior que se acoplan a un dispositivo externo, una aguja para la extracción de sangre o un tubo de boca ancha para la recolección de orina.
- Microtubos: Son tubos pequeños para determinaciones que requieren volúmenes reducidos, como en la punción capilar.
- Jeringas: Utilizadas para la extracción de sangre u otros líquidos de cavidades sin acceso, o cuando se quiere determinar la posible existencia de organismos anaerobios.
- Hisopos: Empleados para la toma de muestras tanto de orificios naturales como de heridas, y suelen ser transportados en medios de cultivo.
- Bolsas de recogida de orina: Bolsas que se adaptan a los genitales de los lactantes para recoger muestras de orina.
Transporte de la Muestra
Las alteraciones de las muestras durante su transporte y cómo resolverlas son:
Proliferación bacteriana: A temperatura ambiente, la proliferación bacteriana es muy intensa. Por lo tanto, algunas muestras no admiten demora, mientras que otras pueden ser refrigeradas para posponer su análisis.
Contaminación de la muestra: Esto puede ocurrir debido a una mala calidad del envase o una manipulación excesiva, lo cual puede generar muchos errores.
Pérdida de la actividad biológica del microorganismo: Muchos microorganismos mueren una vez extraídos del organismo. Esto puede evitarse utilizando sustancias de transporte que mantengan su viabilidad, como el medio de Stuart, que previene la desecación y muerte de los microorganismos recogidos con un hisopo estéril.
Diseminación de los microorganismos al exterior: Esto puede ocurrir por una mala manipulación, ruptura o extravío, y es peligroso porque muchos microorganismos tienen un alto índice de virulencia. Se soluciona informando al personal del transporte sobre la importancia del material, etiquetando claramente el contenido de los recipientes y protegiéndolos en otro recipiente adicional.
Transporte para estudios de anaerobiosis (bacterias que crecen sin oxígeno): En estos casos, debe eliminarse el oxígeno. Se recomienda usar tubos que contengan CO₂. Si la muestra se va a obtener mediante hisopo, el tubo en el que se introduce debe estar en condiciones anaeróbicas.
Procedimientos de Toma de Muestras
Antes de los Procedimientos
Identificación y Comprobación
- Identificar al usuario al que se le realizarán los procedimientos de toma de muestras biológicas.
- Comprobar el aspecto físico del área donde se realizarán los procedimientos.
- Verificar los formularios y protocolos de solicitud analítica.
- Asegurarse de tener los materiales y medios necesarios para el procedimiento.
- Confirmar los requerimientos y la preparación previa del usuario para las pruebas solicitadas.
- Verificar las condiciones especiales que puedan requerir las pruebas solicitadas.
Preparación del Usuario
- Explicar al usuario con antelación suficiente y de manera comprensible qué se le va a hacer, en función de la preparación que requieran las pruebas solicitadas.
- Explicar la forma en que debe colaborar y la importancia de su cooperación.
- Proporcionar la información necesaria sobre el significado de las pruebas que se van a realizar.
- Asegurar la privacidad del usuario durante los procedimientos.
- Si es necesario descubrir zonas íntimas, cubrir adecuadamente al paciente y extremar las medidas de respeto y delicadeza.
- Ayudar al paciente a adoptar la mejor posición para la realización de los procedimientos.
- Si el paciente puede realizar la obtención de las muestras por sí mismo, proporcionar toda la información necesaria y los elementos adecuados.
Preparación del Material y Equipo para la Obtención de Muestras
- Reunir todo el material necesario para la obtención de las muestras y comprobar que es el adecuado para las pruebas solicitadas.
- Asegurar que los materiales se mantengan en condiciones estériles, antes y después de la obtención de las muestras, en los casos que lo requieran.
- Identificar los recipientes en los que se recogerán las muestras biológicas.
- Comprobar que la solicitud analítica esté debidamente cumplimentada, con todos los datos requeridos, en letra clara y legible.
Durante los Procedimientos
- Observar al usuario e intentar identificar sus temores relacionados con los procedimientos a realizar. Intentar ganarse su confianza y tranquilizarlo para asegurar su cooperación.
- Mantener las agujas u otros materiales que puedan causar ansiedad, especialmente en niños, fuera de su vista tanto como sea posible.
- Brindar ayuda física al usuario para que adopte la postura más adecuada para la obtención de la muestra.
- Asegurarse de la viabilidad para la obtención de la muestra y no proceder con el procedimiento si no se tiene completa seguridad.
- Actuar con rapidez y confianza; ser firme pero amable.
- Si la toma de muestra, debido a su especial complejidad, no es realizada por el TCAE, colaborar con el personal facultativo o de enfermería (DUE) en la obtención de la muestra y en asegurar el cumplimiento de los requisitos necesarios para garantizar la calidad de la muestra y brindar la atención adecuada al paciente.
- Observar en todo momento las reacciones del usuario durante el procedimiento y actuar adecuadamente en caso de que surjan situaciones imprevistas.
Después de los Procedimientos
- Aplicar las medidas necesarias para minimizar los riesgos posteriores a la obtención de las muestras, asegurando que el usuario tenga el máximo de comodidad y el mínimo de inconvenientes.
- Observar atentamente la posible aparición de reacciones adversas en el usuario, especialmente si la obtención ha sido traumática, compleja, delicada o difícil.
- Registrar toda la información necesaria en los registros de enfermería y en otros documentos necesarios en cada caso.
- Asegurar el envío al laboratorio de las muestras biológicas lo más pronto posible, cumpliendo con los requisitos indicados en los protocolos y procedimientos correspondientes, y proporcionando toda la información complementaria necesaria para un conocimiento exacto de las circunstancias específicas que pudieran surgir en cada caso.
Sabías que…
Las fases del proceso analítico son:
Fase preanalítica: Incluye todos los procesos desde la solicitud del análisis por parte del clínico hasta el procesamiento de la muestra.
Fase analítica: Comprende todos los procedimientos relacionados directamente con el procesamiento de la muestra.
Fase post-analítica: Se enfoca en la validación de resultados, elaboración y emisión del informe por parte del laboratorio.
Diferentes Tipos de Muestras Biológicas
Muestras de Sangre Arterial y Venosa
Fase Preanalítica
- Volumen: El volumen sanguíneo oscila entre 4.5 y 5.5 L en mujeres y entre 5 y 6 L en hombres. Cuando el volumen sanguíneo está dentro de los valores normales se denomina normovolemia. Si es superior se llama hipervolemia, e hipovolemia si es inferior. Estas variaciones pueden referirse a los componentes celulares de la sangre, denominándose hipersitemia al aumento y oligositemia a la disminución.
- Hemoconcentración: Es la combinación de hipovolemia e hipersitemia.
- Hemodilución: Es la combinación de hipervolemia y oligositemia.
- Densidad: La densidad de la sangre varía con el número de componentes celulares y la composición del plasma, con un valor promedio de 1.005 g/ml.
- Viscosidad: Todos los líquidos pueden cambiar de forma debido a la atracción entre sus moléculas, lo cual se llama viscosidad. En la sangre, la viscosidad depende del contenido y tamaño de las células. Un aumento en el número o tamaño de las células en relación con el plasma aumenta la viscosidad. Otras causas que afectan la viscosidad son:
- Temperatura: La viscosidad disminuye con el calor, por lo que en un sujeto con fiebre, la viscosidad está por debajo de los valores normales.
- Concentración de proteínas: Un aumento en los niveles normales de proteínas en la sangre eleva la viscosidad.
- Dieta: Una alimentación rica y abundante aumenta la viscosidad, mientras que el ayuno, un aumento en la ingesta de líquidos y una dieta rica en vegetales la disminuyen.
- Ejercicio: Valores de viscosidad disminuyen con un trabajo corporal moderado.
- Diferencia entre sangre venosa y arterial: La sangre venosa tiene mayor viscosidad debido a su alto contenido en CO₂, que hace que los eritrocitos se “hinchen”, mientras que la sangre arterial tiene una viscosidad más baja debido a su contenido en O₂.
- Velocidad de Sedimentación Globular (VSG): La VSG es el tiempo que tardan los eritrocitos en sedimentarse una vez que la sangre se extrae del torrente sanguíneo y se deja en reposo. Se mide solo en los eritrocitos por ser la clase celular más abundante en la sangre.
Recogida de Muestras
La recogida de muestras consiste en la extracción de una pequeña cantidad de sangre de una arteria, vena o capilar para análisis de laboratorio. Los fundamentos para la realización de esta técnica son:
- Determinar los componentes normales de la sangre mediante análisis.
- Cuantificar los gases sanguíneos para evaluar la eficacia de la ventilación.
- Detectar la presencia de sustancias extrañas en la sangre.
Los tipos de procedimientos que se pueden realizar son:
Punción Capilar
Se realiza en el pulpejo del dedo o en el lóbulo de la oreja, previamente desinfectados, utilizando una lanceta de Frankel o una lanceta desechable estéril. En niños menores de 4 años, se realiza en el talón. En los centros de salud, este método se utiliza para controlar los niveles de INR y glucemia en pacientes diabéticos y aquellos anticoagulados con sintrón.
Punción Venosa
La muestra venosa es la más común, ya que permite realizar diversos estudios analíticos desde un punto de vista hematológico, bioquímico, microbiológico o inmunológico. El personal encargado de realizar esta técnica es el diplomado en enfermería.
Generalmente, para la extracción venosa (si el estudio es bioquímico), el paciente debe estar en ayunas de 10 a 12 horas. Las venas más utilizadas son la cubital, la cefálica y la basílica en el brazo. Para la extracción, el personal de enfermería coloca un compresor a una distancia de 2-4 dedos por encima de la fosa antecubital, localiza la vena mediante palpación, desinfecta la zona con clorhexidina y realiza una punción rápida para minimizar el trauma vascular y las molestias al paciente. Una vez obtenida la cantidad necesaria, se retira el compresor, se saca la aguja y se coloca un algodón seco en la zona de punción, aplicando presión durante unos minutos.
Si no se puede palpar correctamente la vena en esta zona, se busca otra localización en el antebrazo o la mano. Las muestras no deben obtenerse de catéteres con sueroterapias o tratamientos. En caso de no tener otra opción, se deben eliminar 10 ml antes de realizar la extracción.
La extracción de sangre para cultivo se denomina hemocultivo y se realiza generalmente cuando el paciente tiene un pico febril y se desea identificar el microorganismo causante. Se necesitan dos frascos diferentes por muestra, uno para microorganismos aerobios y otro para anaerobios. Deben realizarse tres tomas distintas, separadas por 30 minutos entre ellas.
Normalmente, cuando se solicita un hemocultivo, se acompaña de un antibiograma, que muestra los antibióticos a los que el germen detectado es resistente y aquellos a los que es sensible.
Una vez que se ha determinado a qué antibióticos es sensible el germen, se instaura el tratamiento antibiótico más adecuado. La vena elegida para el hemocultivo no debe tener ningún catéter venoso conectado. Es importante recordar que si se necesita extraer más sangre para otras pruebas, siempre se debe recoger primero la sangre para el cultivo.
Sabías que…
Después de cualquier cultivo bacteriano (hemocultivo, urocultivo, coprocultivo, etc.), es recomendable realizar un antibiograma para determinar la sensibilidad de los gérmenes a una gama de antibióticos. Este procedimiento generalmente se realiza en una placa Petri. Así se puede utilizar el antibiótico más adecuado para el paciente. Durante la espera de los resultados, se emplea un antibiótico de amplio espectro, que se sustituye por el más adecuado una vez se obtiene el resultado del antibiograma.
Extracción de Sangre Venosa (excepto Hemocultivo)
Material Necesario
- Jeringas de distintas capacidades, según la cantidad necesaria para el análisis prescrito.
- Agujas de 25 x 9 o sistema de extracción al vacío.
- Guantes desechables.
- Algodón o gasas.
- Tubos o frascos adecuados para el tipo de análisis prescrito.
- Povidona yodada o clorhexidina.
- Compresor.
- Esparadrapo hipoalergénico.
| Color del Tapón | Aditivo | Uso Común |
|---|
| Rojo | Sin aditivo | Suero, química clínica, inmunología, serología |
| Amarillo | Gel separador y activador de coágulo | Química clínica, serología, pruebas de sangre |
| Verde | Heparina de sodio o litio | Química clínica, análisis de gases en sangre, estudios bioquímicos |
| Azul Claro | Citrato de sodio | Coagulación, pruebas de coagulación (PT, PTT) |
| Lavanda | EDTA (ácido etilendiaminotetraacético) | Hematología, CBC (recuento sanguíneo completo), hemoglobina glicada (A1C) |
| Gris | Fluoruro sódico y oxalato potásico | Glucosa, pruebas de tolerancia a la glucosa |
| Naranja | Gel separador y trombina | Química clínica, pruebas de coagulación rápida |
| Negro | Citrato de sodio | Pruebas de sedimentación de eritrocitos |
| Azul Oscuro | EDTA o sin aditivo | Toxicología, estudios de metales traza |
| Rosa | EDTA | Banco de sangre, pruebas de compatibilidad |
| Marrón | Heparina de sodio | Pruebas de plomo |
| Blanco | EDTA con gel separador | Plasma, estudios de biología molecular |
| Verde Claro | Heparina de litio y gel separador | Química clínica, estudios bioquímicos, análisis de gases en sangre |
Procedimiento
- El procedimiento es prácticamente el mismo que para el hemocultivo, salvo que la cantidad a extraer depende del tipo de análisis prescrito.
- Si la muestra es para pruebas cruzadas (prueba previa a una transfusión para comprobar el tipo de sangre del paciente y asegurar la compatibilidad), debe estar perfectamente etiquetada con el nombre del paciente y la misma numeración que tendrá la pulsera que se le colocará.
En los niños, especialmente lactantes, se utilizan las venas superficiales del cráneo o la yugular externa.
Gasometría Arterial
La punción arterial se realiza para medir la presión de los gases en la sangre arterial (gasometría arterial = GSA, gasometría venosa = GSV). Otras indicaciones de esta técnica incluyen evaluar la cantidad de oxígeno en sangre, así como aportar datos sobre el pH o el bicarbonato, entre otros.
El sitio más común para este tipo de extracción es la arteria radial y la humeral, aunque también puede realizarse en la arteria femoral o braquial. La jeringa debe estar previamente heparinizada (la heparina es un anticoagulante que evita la coagulación de la sangre), y actualmente estas jeringas ya vienen preparadas.
Si se elige la arteria radial, se debe realizar el test de Allen antes de la extracción. Este test consiste en comprimir las arterias cubital y radial y pedir al paciente que realice 5-10 flexoextensiones de los dedos de la mano. La palma de la mano se pondrá pálida debido a la falta de riego sanguíneo. En ese momento, se libera la arteria cubital; si la palma vuelve a su color inicial en menos de 15 segundos, se considera que la circulación colateral es adecuada y se puede proceder con la punción.
Una vez desinfectado el lugar de punción, se palpa la arteria con el dedo índice y medio de la mano libre. Al percibir la pulsación, se inserta la aguja en el espacio entre los dos dedos, en un ángulo de 45-60 grados. Se puede apoyar la muñeca sobre una superficie cercana al sitio de punción para controlar mejor los movimientos de la mano. La extremidad del paciente debe estar lo más extendida posible. La cantidad usual para una muestra es de 2 a 4 ml y debe enviarse de inmediato al laboratorio, ya que los valores pueden alterarse si no se hace así.
Esta técnica debe ser realizada por personal capacitado, ya que, de lo contrario, pueden ocurrir hemorragias y daños importantes en el paciente.
Muestras de Orina
Valoración Preanalítica de la Orina
A) El color normal de la orina es amarillo, una tonalidad que se debe a los cromógenos que contiene. Dependiendo de la concentración de estos cromógenos, el tono de la orina será más claro o más oscuro. El principal cromógeno es el urocromo.
Si el color de la orina no es amarillento, puede ser debido a diversas patologías:
Coloración rojiza: Causada por la presencia de hematuria de intensidad variable. Si la coloración es rojo-púrpura, puede deberse a la porfiria (alteración hereditaria de la síntesis del grupo hemo). Para detectar el origen de la hematuria, se puede realizar la técnica de los tres vasos. En el caso de mujeres, hay que descartar que la sangre provenga de la menstruación.
Coloración parda: Causada por la presencia de abundante bilirrubina directa, el paciente puede describirla como orina de “color coñac”. También puede ser debido a hematuria intensa donde la hemoglobina se ha degradado en otros pigmentos.
Coloración pardo-naranja o rojo-naranja: Indicativa de la presencia de urobilina.
Coloración pardo-amarilla o pardo-verdosa: Si la espuma es blanca, indica una orina muy concentrada; si es amarilla, indica la presencia de bilirrubina. En la ictericia obstructiva, la orina puede adquirir tonos verdes.
Coloración negra o marrón oscura: Puede deberse a la presencia de metahemoglobina, melanina en la orina o en casos de alcaptonuria (enfermedad del metabolismo de la tirosina).
Aspecto lechoso: Puede deberse a una alta concentración de colesterol y triglicéridos por un síndrome nefrótico o fractura ósea, denominado lipiduria. También puede ser debido a la presencia de parafina de cremas vaginales, pus en la orina (piuria) o linfa en la orina, denominada quiluria, aunque esta última es muy rara.
Ante la aparición de una orina de color anormal, lo primero que se debe hacer es preguntar al paciente sobre su medicación y sus hábitos alimenticios, ya que ciertos fármacos y alimentos pueden causar coloraciones especiales en la orina.
Valoración Preanalítica de la Orina (Continuación)
B) Turbidez
La orina normal es completamente transparente, aunque puede adquirir un aspecto algo turbio debido a la presencia de sales y cristales, especialmente si la orina es concentrada y ha permanecido en reposo. Esta turbidez se elimina agitando la orina. Las sales y cristales normales presentes en la orina incluyen ácido úrico, fosfatos, uratos, carbonatos y oxalatos.
También es normal encontrar hilos de moco de las vías urinarias en la orina. Sin embargo, si la turbidez aparece en la orina recién emitida, puede deberse a:
- Alta presencia de bacterias u hongos.
- Cantidad significativa de leucocitos o eritrocitos.
- Abundante moco de las vías urinarias debido a inflamación.
- Presencia de líquido prostático.
- Presencia de semen.
- Presencia de materia fecal.
Alteraciones del pH
C) Olor
La orina normal tiene un olor característico que se intensifica si la orina está concentrada. En casos de insuficiencia renal aguda, la orina puede carecer de olor.
Cuando la orina se contamina y no es válida como muestra, exhala un olor amoniacal debido a la degradación de la urea.
El olor de la orina puede verse alterado por ciertas enfermedades del paciente. A continuación, se presentan algunas de estas enfermedades y sus características olfativas:
- Cetoacidosis diabética: Olor afrutado.
- Infección urinaria por bacterias: Olor fétido o pútrido.
- Fenilcetonuria: Olor a moho.
- Maple Syrup Urine Disease: Olor a jarabe de arce.
Estas alteraciones del olor pueden proporcionar pistas importantes sobre el estado de salud del paciente.

Recogida de Muestras de Orina
Procedimiento para la Recogida de Orina de 24 Horas (Diuresis)
Materiales Necesarios:
- Frasco para recogida de orina de 2 litros.
- Preservantes para impedir el crecimiento de gérmenes (en algunas determinaciones).
- Frigorífico para la conservación de la muestra.
- Protocolo de información al usuario y dietas (en algunas determinaciones).
Método:
1. Informar al paciente sobre el procedimiento y lograr su cooperación.
2. Iniciar la recogida a primera hora de la mañana, cualquier día excepto sábados o vísperas de festivos (ya que al finalizar la recogida, el laboratorio no puede recibir la muestra).
3. La primera orina emitida el día que se inicia la recogida debe ser desechada. A partir de ese momento, se comienza a contar el período de 24 horas.
4. Durante las 24 horas, se debe recoger toda la orina emitida por el paciente sin perder ninguna cantidad. Si el paciente necesita defecar, debe intentar orinar primero para evitar pérdidas.
5. A la mañana siguiente, al finalizar el período de 24 horas, el paciente debe orinar por última vez, y esta micción sí debe recogerse. Si se necesita una orina reciente o un análisis de orina normal, se aprovechará esta última micción y se recogerá en un recipiente independiente.
6. Una vez finalizada la recogida, se enviará una muestra bien homogeneizada del total de la orina recogida (alícuota) y se anotará la cantidad total de diuresis. En ocasiones, puede ser necesario enviar toda la orina al laboratorio, pero esto no es común.
7. En el caso de niños, si se pierde alguna micción cerca del final del período de recogida, se interrumpirá la recogida y se enviará una alícuota de la orina recogida hasta ese momento, indicando claramente en la solicitud el tiempo transcurrido desde el inicio hasta la última micción obtenida.
8. Existe una variante para la recogida de orina de 24 horas para la determinación de catecolaminas. En este caso, la orina se recoge en un frasco opaco con ácido clorhídrico. Además, se excluirán de la dieta del paciente ciertos alimentos y medicamentos (como antihipertensivos).
Recogida de Muestras de Orina
Procedimiento para la Obtención de una Muestra de Orina de 24 Horas en Pacientes con Sonda Vesical
Para recolectar una muestra de orina de 24 horas en un paciente con sonda vesical, se debe colocar una bolsa de orina nueva a las 8 de la mañana y retirarla a las 8 de la mañana del día siguiente, cambiándola si es necesario.
Recogida de Orina para Examen Básico o Urocultivo
Este procedimiento implica la recogida de una única muestra de orina, generalmente la primera de la mañana, ya que es la más concentrada. Esta muestra se utiliza para evaluar las características físicas (pH, densidad, sedimentos, etc.), realizar estudios bioquímicos (detectar presencia de glucosa, cuerpos cetónicos, sangre, proteínas, etc.) y exámenes microscópicos. En cambio, el urocultivo se utiliza para realizar un estudio microbiológico de la orina y detectar infecciones urinarias.
La muestra de orina que se recoge es la de la mitad de la micción, para evitar la contaminación por microorganismos que normalmente residen en la uretra distal, ya que la primera corriente de orina los arrastra. Se deben extremar las precauciones y mantener condiciones de asepsia en el equipo y el procedimiento de recogida y manipulación.
El auxiliar de enfermería es el encargado de recoger la muestra. Para ello, utiliza un frasco desechable estéril (si es para urocultivo; si no, no es necesario que sea estéril), destinado a este tipo de muestras, y coloca una etiqueta del paciente debidamente cumplimentada (con el nombre y apellidos del paciente, la sala, el número de habitación y de cama). Una vez recogida la muestra, se envía al laboratorio junto con el formulario de análisis, que debe incluir los datos del paciente, del médico que solicita el análisis, la fecha, el posible diagnóstico del paciente, si está recibiendo tratamiento antibiótico y el tipo de análisis solicitado.
Si el urocultivo no puede procesarse inmediatamente, se debe conservar en el refrigerador a una temperatura de 4 °C, por no más de 24 horas. Otra opción es mantener la muestra en medios de transporte con conservantes adecuados si no se puede procesar en las dos horas siguientes.
Material necesario:
- Equipo de higiene genital.
- Recipiente para la recogida de muestras.
- Etiquetas de identificación.
- Guantes desechables.
Procedimiento
Recogida de Muestra de Orina en Mujeres
Se limpia la vulva con una solución limpiadora, moviéndose de adelante hacia atrás. Se separa el labio uretral y se descarta una pequeña cantidad de orina al inicio de la micción, recogiendo la muestra de la mitad de la micción en un recipiente estéril, el cual se cierra inmediatamente.
Recogida de Muestra de Orina en Hombres
Se retira el prepucio y se lavan el glande y el área alrededor del meato urinario. Este se limpia en un movimiento circular hacia afuera para evitar desplazar microorganismos del orificio hacia las vías urinarias. Después de la limpieza, se recoge la orina, desechando la primera parte.
Si no se dispone de una solución limpiadora, se puede usar agua y jabón. Si se utiliza un preparado de yodo para la limpieza, es importante enjuagar cuidadosamente el yodo con agua antes de tomar la muestra, ya que cualquier residuo puede alterar los resultados de la prueba.
Recogida de Muestra de Orina en Pacientes Sondados
Se pinza la sonda durante 30 minutos, luego se desinfecta el exterior de la sonda con povidona yodada, se espera 2 minutos para que se seque, se pincha con una jeringa estéril y se extraen 5 ml de orina. Después, se despinza y se recoge la orina en un frasco estéril. Una variante de la técnica es usar un sistema de extracción al vacío, traspasando la orina de un frasco estéril al envase definitivo que se enviará al laboratorio. La muestra debe enviarse al laboratorio inmediatamente o conservarse en el refrigerador si no es posible.
Recogida de Muestra de Orina en Niños con Incontinencia de Esfínteres
Se lava la zona perineal y se utiliza una bolsa colectora estéril como dispositivo de recogida, que tiene una superficie adhesiva para facilitar su colocación.
Muestra por Punción Suprapúbica
La punción suprapúbica (PSP) es una técnica ampliamente aceptada para la obtención de muestras de orina estéril en neonatos lactantes con sospecha de infección urinaria, ya que evita que la orina pase por la uretra. Consiste en la recolección de orina directamente de la vejiga mediante una punción. Es una técnica rápida, simple y segura. Este procedimiento es realizado por el facultativo con la colaboración del equipo de enfermería.
Material para Punción
- Solución antiséptica
- Gasas de algodón estériles
- Guantes
- Aguja calibre 19-21
- Jeringa estéril de 5-10 ml
- Frasco para cultivo
Técnica
El procedimiento es realizado por el facultativo con la ayuda del personal de enfermería para inmovilizar al neonato rápidamente antes de que miccione espontáneamente.
1. Asegurar un buen aporte de líquidos hasta que la vejiga esté llena.
2. Inmovilizar al paciente en posición de decúbito dorsal.
3. Limpiar el cuadrante medio inferior del abdomen con solución antiséptica.
4. Secar el área.
5. Localizar la sínfisis púbica con un dedo.
6. Insertar la aguja con la jeringa colocada 1 cm por encima de la sínfisis púbica en la línea media.
7. Puncionar en dirección al cóccix en un ángulo de 30º hasta llegar a la cavidad vesical (2-3 cm de profundidad).
8. Aspirar hasta obtener 5-10 ml de orina.
9. Retirar la aguja junto con la jeringa.
10. Limpiar el área de punción con solución antiséptica.
11. Cubrir el punto de punción con una gasa estéril.
Contraindicaciones
- Vejiga vacía (micción reciente, deshidratación)
- Infección de la piel en el sitio de punción
- Dilatación abdominal
Observaciones
- Evitar el uso de soluciones yodadas como antiséptico en menores de seis meses.
- Asegurarse de que la vejiga está llena, utilizando ecografía si es posible, o verificando que el niño lleva al menos una hora sin orinar.
- Para aliviar el dolor, se puede aplicar una crema antiséptica mezclada con anestésicos locales de forma tópica, en cura oclusiva, 30-60 minutos antes del procedimiento.
Complicaciones Raras
- Hematuria transitoria (sangre en orina)
- Perforación intestinal, lo que podría contaminar la muestra (flora mixta)
- Infección
Volumen Mínimo de la Muestra
Es suficiente un volumen de 5-10 ml de orina.
Transporte
La muestra de orina debe llegar al laboratorio en el plazo de una hora. Si no es posible, debe refrigerarse a 4 °C durante un máximo de 12 horas.
En Adultos
Esta prueba se realiza en adultos cuando es necesaria la evacuación vesical, como en casos de retención urinaria aguda donde no ha sido posible sondar la vejiga o cuando la introducción de sondas filiformes está contraindicada. También se realiza cuando se necesita drenaje vesical debido a infecciones uretrales o prostáticas, o en caso de ruptura uretral por traumatismo pélvico donde no es posible o está contraindicado el cateterismo uretral.
En estos casos, se realiza un drenaje suprapúbico, que consiste en la colocación de un catéter intravesical a través de un acceso percutáneo en la región suprapúbica. Es fundamental que se palpe un globo vesical o que se visualice mediante ecografía antes de realizar la punción suprapúbica. El mecanismo de fijación del catéter puede ser interno o autorretentivo, y de fijación externa, similar a las sondas uretrales.
Si la persona lleva una sonda de cateterización vesical permanente, es necesario pinzar la sonda con una pinza de Kocher durante 30-60 minutos antes de la punción suprapúbica.
Muestra de Heces
El estudio microbiológico de las heces se llama coprocultivo y es realizado por el personal de enfermería. La muestra debe ser de heces recién emitidas, y la cantidad mínima necesaria debe ser de 1 o 2 gramos si son heces formadas o pastosas, y entre 5 y 10 ml si son líquidas. Se deben seleccionar porciones que contengan sangre, moco o pus. Las muestras contaminadas con orina no son adecuadas. Una vez recogida, la muestra debe enviarse al laboratorio en menos de 30 minutos. Si no es posible enviarla en ese tiempo, debe conservarse en el refrigerador.
Diferentes Estudios que se Pueden Realizar:
Estudio Bacteriológico: Las muestras deben recogerse en un recipiente estéril y enviarse rápidamente al laboratorio para su procesamiento, ya que muchos patógenos intestinales pueden morir o su presencia puede enmascararse debido al sobrecrecimiento de la flora microbiana normal.
Estudio Parasitológico: Las muestras de heces deben recogerse en un recipiente estéril, seco y hermético, y se deben enviar al laboratorio al menos tres muestras tomadas en días distintos. Un resultado negativo de una sola muestra tiene un valor limitado.
Examen de Oxiuros (parche de Jacobs, técnica de Graham o panel adhesivo): La muestra debe tomarse a primera hora de la mañana antes de la defecación y el lavado. Se realiza separando los glúteos y utilizando una tira adhesiva (papel, sello, etc.) que se pega durante unos momentos en las paredes del ano para arrastrar los huevos, luego se pega en un portaobjetos y se envía al laboratorio para su examen. Esta técnica se basa en que la hembra del oxiuro deposita los huevos alrededor del ano durante la noche.
Toma de Muestra para Determinación de Sangre Oculta en Heces
Para asegurar una correcta determinación de sangre oculta en heces, es crucial seguir estas recomendaciones:
- No consumir los siguientes alimentos tres días antes de la recogida de las heces y durante todo el período de recolección: embutidos, picantes, frutas, rábanos y tomates.
- No tomar aspirinas ni productos que contengan ácido acetilsalicílico. También evitar la vitamina C y alimentos que la contengan (naranjas, limones, pomelos, etc.).
- Se recomienda seguir una dieta rica en fibra (verduras, ensaladas, nueces, pan integral, etc.), excluyendo los alimentos prohibidos.
- Después de observar esta dieta, recoger dos muestras de diferentes partes de las heces en tres deposiciones consecutivas.
- No cepillarse los dientes con cepillos de cerdas duras durante estos días para evitar pequeñas hemorragias en las encías, que podrían causar falsos positivos.
- Cada muestra recogida debe ser colocada en el recuadro correspondiente en la cartulina del test facilitado por el laboratorio.
- Las mujeres no deben realizar esta prueba durante su período menstrual. Deben esperar tres días después de que finalice. Si la menstruación comienza durante la recolección, deben suspenderla y empezar de nuevo tres días después de que termine.
- La preparación adecuada para la determinación analítica de sangre oculta en heces se realiza mediante el método de Hemoccult®, Hemoccult II®, Smith Kline Diagnostics, Sunnyvale, California.
Toma de Muestra para la Determinación de Digestión de Principios Inmediatos en Heces
Para realizar este análisis, el paciente debe seguir el siguiente régimen alimenticio:
Tres días antes de la recogida de las heces, se debe añadir a la alimentación normal del paciente:
- 150 gramos de carne a la plancha.
- 100 gramos de mantequilla.
- 150 gramos de patatas.
Al cuarto día de seguir esta dieta, se procederá a la recogida de las heces en el frasco proporcionado por el laboratorio.
La muestra debe entregarse por la mañana (de lunes a viernes), antes de las 10:30 horas. Si la recogida de las heces se realiza a una hora distinta, debe conservarse en el refrigerador hasta su envío al laboratorio.
Valoración Preanalítica de las Heces
Existen varios parámetros a considerar al valorar o inspeccionar las heces:
- Color:
- Heces marrones = Situación normal.
- Heces blancas = Sospecha de obstrucción biliar.
- Heces negras = Sospecha de sangrado en el tracto gastrointestinal superior.
- Heces rojas = Sospecha de sangrado en el tracto gastrointestinal inferior.
- Heces pálidas = Dieta pobre en carnes.
- Heces verdes = Sospecha de infección intestinal.
- Consistencia:
- Heces formadas, blandas, semisólidas = Heces normales.
- Heces duras y secas = Sospecha de deshidratación o falta de fibra en la dieta.
- Heces líquidas = Diarrea, aumento del peristaltismo intestinal.
- Olor:
- Si el olor de las heces es muy penetrante, se sospecha de infección o presencia de sangre.
Muestra de Esputos
El esputo es una mezcla de secreciones del tracto respiratorio inferior y superior, aunque las muestras solicitadas para pruebas suelen ser del tracto respiratorio inferior. La forma de recoger esta muestra es crucial, ya que se puede contaminar fácilmente con la flora orofaríngea. Para evitar esto, se recomienda al paciente enjuagarse la boca con solución salina o agua templada antes de la recolección, pero nunca usar antisépticos. La muestra de esputo puede obtenerse de manera voluntaria o involuntaria.
Si el paciente tiene dificultad para expectorar, se le puede ayudar colocándolo en la posición adecuada para el drenaje y pidiéndole que tosa mientras se le golpea suavemente (clapping) en la zona donde se sospecha la patología pulmonar. Otra manera de facilitar la expectoración es mediante nebulizaciones (fluidoterapia) con una solución hipertónica de cloruro sódico (5-10%) calentada, que humedece el aire y facilita la acción de los cilios para ascender las secreciones deshidratadas, viscosas y gruesas. Si el paciente sigue sin poder expectorar adecuadamente, se puede recoger la muestra mediante un dispositivo de aspiración, similar al utilizado en pacientes traqueotomizados, con un bote recolector situado entre la sonda de aspiración y el sistema generador de aspiración.
Se recomienda recoger el primer esputo de la mañana en un envase estéril con cierre de rosca. Si no se puede enviar rápidamente al laboratorio (en menos de dos horas), debe conservarse en refrigeración a 4 °C. El volumen recomendado de la muestra es de 5 a 10 ml cuando sea posible. Para estudios microbiológicos, se debe recoger la muestra durante tres días consecutivos (cultivo de Lowenstein-Jensen para tuberculosis).
Valoración Preanalítica del Esputo
Normal: En condiciones normales, la mayoría de las muestras de esputo tienen un aspecto acuoso y claro, con una ligera opacidad debido al material celular en suspensión.
Anormal: En condiciones patológicas, el esputo puede presentar diferentes aspectos:
- Seroso: Líquido.
- Mucoso: Blanquecino y muy adherente, con predominio de moco.
- Purulento: Contiene pus.
- Sanguinolento: Contiene pequeñas cantidades de sangre.
También puede haber combinaciones de estos tipos, como esputo sanguinolento y purulento (tuberculosis), seroso purulento, mucopurulento (amarillo-verdoso y viscoso), etc. Las enfermedades específicas suelen presentar esputos con consistencias y aspectos característicos; por ejemplo, en el edema agudo de pulmón, el esputo es frecuentemente seroso y sanguinolento.
Muestra de Vómitos
El vómito es la expulsión del contenido del estómago, duodeno o intestino a través de la boca. Sin embargo, no debe confundirse con la regurgitación, que es la llegada de contenido gástrico a la boca sin los esfuerzos típicos del vómito.
Tipos de Vómitos
- Vómitos Reflejos: Se dividen en dos grandes grupos:
- Vómitos Gástricos: El origen del vómito es el estómago, como en casos de gastritis aguda o cáncer gástrico.
- Vómitos Extragástricos: El estímulo del vómito proviene de otras partes del cuerpo, como la apendicitis, hepatopatías o patología de la vía biliar.
- Vómitos Centrales: Las causas de estos vómitos pueden ser tumores craneales, vómitos histéricos, entre otros.
Valoración desde el Punto de Vista de Enfermería
- Cantidad de Vómitos: Es un parámetro importante para establecer el balance hidro-electrolítico.
- Naturaleza del Vómito:
- Vómito Alimenticio: Contiene comida reciente.
- Vómitos Fecaloideos: Indican la existencia de una obstrucción intestinal.
- Olor del Vómito:
- Olor Agrio o Putrefacto: Puede indicar una estenosis de píloro.
- Olor Nauseabundo: Puede indicar la presencia de sangre (hematemesis).
- Horario de los Vómitos:
- Vómitos Matutinos: Ocurren por la mañana.
- Vómitos Postpandriales: Ocurren después de comer.
Estas valoraciones ayudan a entender mejor las causas y características de los vómitos, permitiendo una atención más precisa y adecuada al paciente.
Muestra de Drenajes Gástricos
El análisis de la secreción gástrica, al igual que muchas otras pruebas de laboratorio, por sí solo rara vez tiene un valor diagnóstico significativo. Es necesario interpretarlo en el contexto de la historia clínica del paciente y los resultados de otras pruebas. Además, los análisis gástricos no tienen intervalos de normalidad estrictamente definidos.
La gastroscopia o endoscopia gástrica, la radiología y la citología gástrica obtenida mediante biopsia son herramientas mucho más útiles para establecer el diagnóstico de patologías gástricas que el análisis del jugo gástrico.
Aunque la técnica no es invasiva, la entubación puede resultar desagradable e incluso traumática para el paciente. Debido a sus limitaciones y valor actual, el análisis del jugo gástrico se realiza con poca frecuencia.
Indicaciones
En general, el análisis del jugo gástrico se lleva a cabo por las siguientes razones:
- Para determinar la capacidad de secreción de ácido clorhídrico (HCl): El hallazgo de aclorhidria es crucial para el diagnóstico de anemia perniciosa y cáncer gástrico.
- Para evaluar la cantidad de HCl en pacientes con síntomas de úlcera péptica: Especialmente en aquellos con sospecha de úlcera duodenal, donde no se observa lesión en los estudios radiológicos.
- Para confirmar un estado hipersecretorio característico del síndrome de Zollinger-Ellison: Este es un tumor de las células que secretan gastrina, la hormona responsable de la estimulación de la secreción gástrica.
- Para contribuir al diagnóstico diferencial entre úlcera gástrica y duodenal:
- Los pacientes con úlcera gástrica tienden a tener índices de secreción de HCl normales o ligeramente disminuidos en comparación con sujetos normales.
- En general, los pacientes con úlcera duodenal secretan más HCl que los normales.
- Ante la sospecha de retención gástrica debido a estenosis del píloro.
Estas indicaciones ayudan a determinar cuándo es apropiado realizar un análisis de jugo gástrico y a interpretar los resultados en el contexto de la condición clínica del paciente.
Contenido de la Secreción Gástrica
La secreción gástrica es una solución compleja que incluye varios componentes importantes:
- Ácido clorhídrico (HCl): El HCl es secretado por las células parietales de las glándulas gástricas ubicadas en el fondo y cuerpo del estómago. Su función principal es:
- Activar el pepsinógeno para convertirse en pepsina, una enzima crucial para la digestión de las proteínas.
- Acidificar el bolo alimenticio para facilitar la digestión.
- Actuar como un agente antiséptico, previniendo infecciones gastrointestinales.
- En pequeñas proporciones, participar en la hidrólisis de polipéptidos y polisacáridos.
- Electrolitos: La secreción gástrica contiene todos los electrolitos que se encuentran en otros fluidos corporales. Las concentraciones varían ampliamente entre individuos, con excepción del ion H, las variaciones no suelen tener significado clínico.
- Enzimas digestivas:
- Pepsina: Es la principal enzima digestiva en el estómago, segregada por las células principales de las glándulas gástricas del cuerpo y fondo. Se libera como pepsinógeno y se activa por el HCl. La pepsina desempeña un papel fundamental en la digestión de las proteínas.
- Lipasa gástrica: Se secreta en cantidades muy pequeñas pero es importante para la digestión de las grasas, especialmente en casos donde la función pancreática no está completamente desarrollada, como en los recién nacidos.
- Enzimas no digestivas: Incluyen la fosfatasa alcalina y la láctico-deshidrogenasa, presentes en el tubo gástrico pero sin función conocida en la digestión.
- Moco: El moco gástrico es una mezcla compleja de mucoproteínas y mucopolisacáridos que protegen la mucosa gástrica. Es secretado por las glándulas mucosas que recubren toda la mucosa del estómago.
- Otras sustancias:
- En la secreción gástrica normal también se encuentran pequeñas cantidades de albúmina y γ-globulinas séricas.
- Factor intrínseco: Segregado por las células parietales de las glándulas del cuerpo y del fondo, esta glucoproteína facilita la absorción de la vitamina B12 en el íleon.
- Hormona gastrina: Producida por las glándulas pilóricas, la gastrina estimula la secreción del jugo gástrico y tiene una leve actividad proteolítica.
Estos componentes trabajan en conjunto para asegurar la adecuada digestión de los alimentos y mantener la salud de la mucosa gástrica. La composición y función de la secreción gástrica pueden variar según el estado de salud y las condiciones fisiológicas del individuo.
Obtención de la Muestra de Jugo Gástrico
Para obtener una muestra de jugo gástrico con fines diagnósticos, se deben seguir los siguientes procedimientos:
- Preparación del paciente:
- El paciente debe ayunar durante al menos 12 horas antes de la extracción del jugo gástrico.
- Bajo supervisión médica, se suspende toda medicación que pueda afectar la secreción ácida gástrica.
- Se informa detalladamente al paciente sobre el procedimiento para asegurar su cooperación máxima.
- El paciente se coloca en posición sentada o semisentada y se protege con una sábana para mantener la comodidad y la privacidad.
- En circunstancias excepcionales, podría requerirse la aerosolización con anestesia local antes de la entubación.
- Estimulación de la secreción ácida:
- Para medir la secreción máxima de ácido clorhídrico (HCl), se puede administrar un inyectable de gastrina o histamina para estimular la producción ácida.
- El procedimiento sigue estos pasos:
- Se realiza la primera extracción del jugo gástrico residual antes de la estimulación, colocándola en una probeta etiquetada como A.
- Se inyecta el estimulante (gastrina o histamina).
- Se realizan extracciones cada 15 minutos en diferentes probetas identificadas como B, C, D, y E.
Valoración Preanalítica
Antes de analizar el jugo gástrico obtenido, se consideran varios aspectos importantes:
- Volumen y características físicas:
- El volumen de jugo gástrico obtenido suele ser mínimo, generalmente inferior a 50 ml, salvo en casos de neoformaciones donde podría estar aumentado.
- El color normalmente es incoloro o amarillento, pero puede presentar tonalidades patológicas como rojizas, que podrían indicar presencia de sangre si la muestra fue traumática.
- La presencia de tonalidades verdosas puede ser indicativa de reflujo gastroduodenal.
- Olor:
- El jugo gástrico normalmente tiene un olor agrio característico, que puede volverse rancio en casos de estenosis, o pútrido en presencia de neoformaciones.
- En pacientes con obstrucciones intestinales, el olor puede ser fecaloideo, a menudo asociado con vómitos fecaloideos.
Estos criterios son cruciales para la evaluación inicial del jugo gástrico obtenido, proporcionando información valiosa para el diagnóstico y manejo de diversas condiciones gastrointestinales.
Muestra y Valoración de Exudados
Los exudados incluyen una variedad de muestras que requieren diferentes métodos de procesamiento según su origen. Los microorganismos presentes en los exudados dependen del lugar de la lesión y las áreas cercanas a la misma. Por lo tanto, los protocolos deben estar completamente detallados con el diagnóstico clínico, tipo de muestra enviada y tratamiento antibiótico recibido.
La obtención de la muestra generalmente la realiza el médico o el Diplomado en Enfermería, siempre con fines diagnósticos. La función del Técnico en Cuidados Auxiliares de Enfermería (TCAE) es preparar todo el material necesario para la obtención de la muestra y estar presente durante todo el proceso.
Exudado de Heridas
Las infecciones en heridas son generalmente causadas por bacterias y, ocasionalmente, por micobacterias y hongos. Los hisopos rara vez contienen material suficiente para el examen microscópico y cultivos, pero en caso de obtener una muestra con ellos, deben utilizar un medio de transporte adecuado (tipo Stuart-Amies). La forma más correcta de tomar la muestra (en caso de pus y exudados) es mediante aspirado con aguja y jeringa. Antes de proceder al aspirado de áreas profundas para obtener pus, se debe limpiar la superficie de la herida con suero fisiológico. El volumen mínimo necesario es entre 1 y 10 ml (en caso de que la muestra sea líquida).
Cuando la muestra obtenida sea insuficiente, se debe inyectar suero salino y aspirarlo nuevamente en la jeringa. Esta muestra debe enviarse al laboratorio en menos de dos horas, utilizando medios de transporte que permitan la conservación de la muestra a temperatura ambiente hasta su procesamiento.
Exudado de Abscesos
El TCAE es responsable de preparar el material necesario para la toma de la muestra (paños estériles, gasas estériles, guantes estériles, antiséptico, frasco estéril, jeringa y agujas estériles).
Para obtener la muestra, se debe desinfectar la zona primero con alcohol etílico al 70% y luego con povidona yodada al 10%, utilizando movimientos circulares desde la zona donde se realizará la punción hacia afuera. Posteriormente, se extrae la muestra de forma aséptica mediante punción y aspiración. La cantidad mínima necesaria para que la muestra sea adecuada es entre 5 y 10 ml. Una vez recogida, la muestra debe enviarse de inmediato al laboratorio. Si no es posible el envío inmediato, debe conservarse en una estufa a 35-37 °C y, si no hay estufa disponible, mantenerla a temperatura ambiente. No debe refrigerarse.
Exudado Faríngeo
El cultivo de exudado faríngeo o frotis faríngeo se realiza utilizando un hisopo especial para detectar la presencia de estreptococo del grupo A, la causa más común de la faringitis estreptocócica. Una muestra tomada de la pared posterior de la garganta se coloca en una placa de Petri (cultivo) que permite el crecimiento de las bacterias. El tipo específico de infección se determina mediante análisis químicos.
También se utiliza en la detección de la COVID-19 a través de una prueba de PCR en el laboratorio, realizada a partir de un exudado nasofaríngeo.
Muestra de Líquido Cefalorraquídeo
Valoración Preanalítica del Líquido Cefalorraquídeo
El líquido cefalorraquídeo (LCR) debe tener un aspecto claro, incoloro y no presentar sedimentos. Cualquier alteración en estas características indica una patología en el LCR. Cuando se obtiene la muestra, generalmente no se coloca en tubos graduados, por lo que para conocer la cantidad extraída se debe llenar un tubo similar con agua hasta igualar los niveles y luego medir el volumen de agua utilizado. Debido a las características específicas de la muestra, se debe intentar minimizar las manipulaciones.
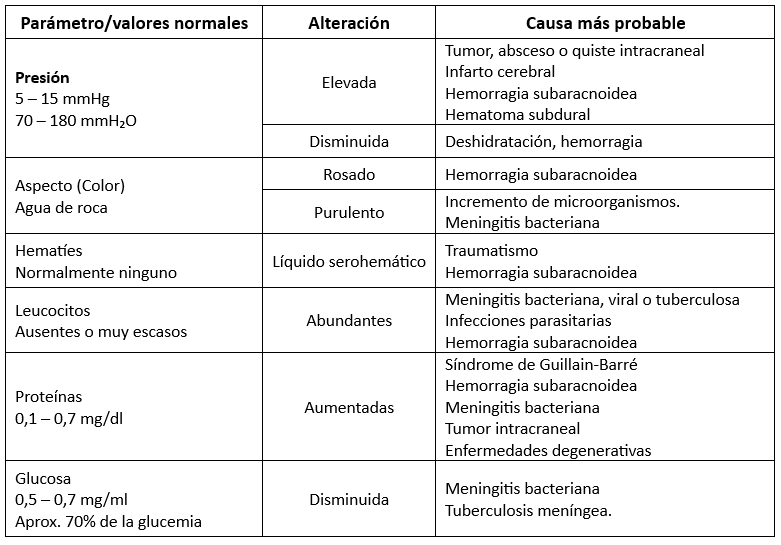
Las coloraciones amarillentas-rosáceas en el LCR, conocidas como xantocromía, se deben a la presencia de hemoglobina o sus productos de degradación. Esta coloración puede aparecer principalmente por:
- Técnica de punción traumática.
- Contaminación de la muestra.
- Alta concentración de proteínas.
- Hemorragia subaracnoidea.
Otras coloraciones posibles del LCR incluyen:
- Hemorrágica: si es causada por una punción traumática, se identificará por las mismas razones que en los casos anteriores. Puede deberse a una hemorragia subaracnoidea o a un hematoma cerebral abierto.
- Opalescente.
- Turbia: generalmente se asocia a meningitis bacteriana purulenta, aunque también puede ser causada por un absceso cerebral. La turbidez se evalúa de la siguiente manera:
- Ninguna cruz: Transparente
- +: Ligeramente turbio
- ++: Claramente turbio aunque se puede leer a través de él
- +++: No se puede leer a través de él
- ++++: No se distinguen las letras.
Otra característica a considerar al analizar el LCR es la presencia de coágulos. Fisiológicamente, no deberían aparecer coágulos en la muestra, pero pueden formarse por las siguientes razones:
- Coágulos precipitantes: Meningitis purulenta
- Tela de araña: Meningitis tuberculosa
- Flóculos múltiples: Sífilis
Recogida de Muestras de Líquido Cefalorraquídeo
La extracción del líquido cefalorraquídeo (LCR), el cual llena los ventrículos cerebrales y los espacios subaracnoideos del cerebro y la médula espinal, se conoce como punción lumbar, espinal o raquídea. El LCR normalmente es transparente; la presencia de sangre le da una coloración rojiza, y las infecciones pueden causar turbidez.
La punción lumbar se realiza con fines diagnósticos o terapéuticos. Con fines diagnósticos, se busca investigar los componentes del LCR o medir su presión. Con fines terapéuticos, se pretende reducir la presión del LCR, introducir aire o realizar raquianestesia.
El lugar adecuado para la punción es entre las vértebras lumbares 3, 4 y 5 (L3, L4 y L5), siendo más común entre L3 y L4. La técnica la ejecuta el médico, mientras que el personal de enfermería y el TCAE asisten tanto al médico como al paciente. Es una técnica aséptica.
El paciente debe estar en posición de decúbito lateral, al borde de la cama y con la espalda arqueada, incluso con la cabeza apoyada en las rodillas (posición fetal). Durante la punción, es crucial vigilar el estado de consciencia y la ventilación del paciente. Si presenta mareos o cefalea intensa, se interrumpe el procedimiento.
La presión normal inicial del LCR es de 60-180 mm H2O, dependiendo del tipo de manómetro utilizado.
Procedimiento
1. Informar al paciente sobre el procedimiento y la importancia de su colaboración.
2. Colocar al paciente en la posición adecuada.
3. Desinfectar la piel con povidona yodada hasta la cresta ilíaca.
4. El médico, vestido de manera estéril, colocará los paños estériles (uno debajo del paciente y otro en la zona de la punción).
5. Al retirar el fijador del trocar, el médico recogerá la muestra de LCR o aplicará el manómetro para medir la presión del líquido. El LCR que fluye del trocar se distribuye en varios tubos (generalmente tres tubos estériles) para microbiología, bioquímica, anatomía patológica, etc.
6. Una vez retirado el trocar, se presiona la zona de punción con una gasa estéril.
7. Se desinfecta nuevamente la zona de punción y se cubre con un apósito estéril.
8. Se coloca al paciente en posición de decúbito supino y sin almohada por al menos dos horas.
9. Durante las primeras horas posteriores al procedimiento, se debe controlar la presión arterial del paciente.
10. Durante las 4 horas posteriores a la finalización del procedimiento, el paciente deberá permanecer en ayuno absoluto.
11. Una vez recogida la muestra, debe ser transportada inmediatamente al laboratorio para su análisis. El transporte puede realizarse en un tubo de ensayo estéril o, preferentemente, en un vial de transporte con un medio adecuado (como Columbia agar). Si no es posible enviar la muestra de inmediato al laboratorio, debe conservarse en una estufa a 37 °C, nunca refrigerada ni congelada. Si no se dispone de una estufa, se puede inyectar parte del LCR en un frasco de hemocultivo y mantenerlo a temperatura ambiente.
Muestra de Líquido Pleural
Valoración Preanalítica del Líquido Pleural
Una vez identificada correctamente la muestra, se procederá a su evaluación preanalítica. El color normal del líquido pleural debe ser transparente y amarillo pálido, pero pueden presentarse otras tonalidades que indican posibles patologías:
- Amarillo pálido que no se coagula: Indica un hidrotórax, un derrame debido a un trasudado, que puede aparecer en casos de insuficiencia cardíaca congestiva (ICC) o en síndromes nefróticos.
- Hemorrágico: Una tonalidad hemorrágica en una punción pleural puede ser resultado de una punción traumática. Si este color disminuye a medida que avanza la aspiración, es indicativo de una punción traumática. Si el color permanece constante, se trata de un derrame hemático, que puede presentarse en casos de infarto o neoplasia pulmonar.
- Sangre: Indica un hemotórax, generalmente causado por heridas punzantes o fracturas de costillas con extravasación sanguínea.
- Turbio: Normalmente debido a la presencia de leucocitos y proteínas en altas concentraciones.
- Purulento: Indica la presencia de un empiema.
- Achocolatado: Sugiere la presencia de un absceso amebiano.
- Lechoso:
- Quilotórax: Derrame quiloso causado por la extravasación de linfa debido a la obstrucción de los conductos linfáticos.
- Derrame pseudoquiloso: Se debe a procesos crónicos como la tuberculosis, resultando en un acúmulo de colesterol y restos de lípidos celulares de hematíes y leucocitos.
Recogida de Muestras
Punción Pleural o Aspiración Torácica
También conocida como toracocentesis, esta técnica consiste en la evacuación de sustancias extrañas (sangre, pus, aire, etc.) del espacio interpleural.
Después de realizar la punción, para efectuar el drenaje, se conectará al sistema de aspiración conocido como Pleur-Evac.
Material Necesario
- Protector de cama.
- Paños estériles fenestrados.
- Algodones estériles.
- Jeringas con anestésico local (solución al 1% de procaína o novocaína).
- Guantes estériles.
- Apósitos estériles.
- Tela adhesiva o esparadrapo.
- Sistema de aspiración.
- Agujas de diferentes tamaños y bisel corto para evitar perforar el pulmón.
- Agujas delgadas para exudados serosos.
- Agujas gruesas para exudados purulentos.
- Catéter de plástico que pasa a través de una aguja, reduciendo el riesgo de punción pulmonar.
- Pinzas estériles.
Preparación del Paciente
- Informar al paciente sobre el procedimiento.
- Colocar al paciente en una posición cómoda y adecuada. Las posibles posiciones son:
- Decúbito lateral o prono.
- Acostado sobre el lado afectado, con el brazo de ese lado sobre la cabeza o hacia adelante.
- Sentado al lado de la cama con los pies apoyados en un cojín colocado en el respaldo de una silla.
- Asegurarse de que el paciente esté abrigado para evitar enfriamientos, descubriendo solo la zona necesaria para la punción.
Procedimiento
1. Verificación del aparato de aspiración: Colocar el tubo que se conectará con la aguja de aspiración dentro de un vaso con agua y abrir la llave de paso correspondiente. Si el agua fluye rápidamente dentro del frasco, el líquido torácico también lo hará.
2. Limpieza y desinfección: Limpiar y desinfectar la piel en la zona de la punción con una gasa estéril impregnada en povidona yodada.
3. Anestesia local: Aplicar anestésico local en el punto de punción.
4. Realización de la punción: Insertar la aguja en el punto medio entre dos costillas para evitar los vasos intercostales, durante la inspiración, cuando los espacios intercostales son más anchos.
5. Instrucciones al paciente: El enfermero o la enfermera instruirá al paciente para que no se mueva ni tosa mientras la aguja esté en la pared torácica. Si la tos es inevitable, el cirujano torácico, quien usualmente realiza la punción, retirará temporalmente la aguja.
6. Adaptador de tres vías: Conectar a la aguja un adaptador con llave de tres pasos para evitar la entrada de aire en la cavidad pleural, cerrando la llave.
7. Conexión al sistema de succión: Conectar el adaptador al sistema de succión.
8. Apertura de la llave de paso: Al abrir la llave de paso, el líquido debe fluir al frasco de vacío.
9. Obtención de muestra no contaminada: Si se necesita una muestra para análisis, se puede obtener mediante una jeringa y depositarla en un recipiente estéril, etiquetando el frasco con la fecha, nombre del paciente, departamento clínico, naturaleza del líquido y los análisis a realizar.
10. Monitoreo del paciente: Observar cuidadosamente el estado del paciente durante todo el procedimiento (color, pulso, respiración). Vigilar el esputo, ya que los esputos sanguinolentos podrían indicar una lesión en el tejido pulmonar.
11. Atención a posibles complicaciones: Estar atento a complicaciones como hemorragias por lesión de los vasos intercostales, la vena cava o el corazón, hipovolemia por pérdida de sangre y, como consecuencia, shock.
12. Registro y anotación del tratamiento: Documentar la cantidad, color, tipo de líquido extraído, duración del tratamiento y cualquier síntoma observado.
13. Anotación de muestras: Registrar las muestras obtenidas y el motivo por el cual se envían al laboratorio.
Muestras del Aparato Respiratorio
Boca
El tipo de muestra dependerá de la lesión presente. Para úlceras y candidiasis (muguet), la muestra se toma de la zona lesionada utilizando una torunda. En el caso de abscesos, la muestra se obtiene con jeringas y se procesa para aislar anaerobios.
Garganta
Las muestras pueden ser exudado de garganta, exudado o aspirado de nasofaringe, o exudado de amígdalas.
Para una muestra nasofaríngea, se introduce la torunda a través de las fosas nasales hasta la nasofaringe. Una vez allí, se mantiene la torunda cerca del septo y del suelo de la fosa nasal, girándola suavemente. Luego, se extrae la torunda, se identifica y se envía al laboratorio en menos de dos horas.
Para obtener un exudado faringoamigdalino, se necesita un depresor lingual y una torunda de algodón. Con el depresor lingual, se hace rodar la torunda sobre las amígdalas y la faringe posterior, tocando todas las áreas con exudado o inflamación, evitando la mucosa oral, lengua y úvula. Una vez obtenida la muestra, se envía al laboratorio lo más rápidamente posible, sin necesidad de un medio de transporte especial.
Nariz
Las muestras pueden ser exudado de las fosas nasales o secreciones nasales. Para esto, se introduce la torunda en la nariz, se gira contra la mucosa y luego se extrae. La torunda se cierra, se identifica con los datos del paciente y se envía al laboratorio en menos de dos horas.
Senos Paranasales
La muestra puede obtenerse mediante punción del seno o utilizando un escobillón especial que recoja la muestra de esta área.
Laringe, Tráquea y Bronquios
Las muestras pueden ser esputo, aspirado bronquial, aspirado transtraqueal o aspirado transpulmonar.
Pelo, Piel y Uñas
Las técnicas utilizadas dependen del objetivo y de la sospecha diagnóstica:
- Uñas: Se raspa la zona afectada y se corta un fragmento para buscar micosis. Si hay lesión en el lecho ungueal, se utiliza un hisopo.
- Cabello: Si hay signos de micosis, se arrancan varios pelos con una pinza y se colocan en un recipiente estéril. Si hay lesiones en el cuero cabelludo, se raspan y se colocan en otro recipiente.
- Piel: Las áreas con alteraciones por hongos se raspan con bisturí o lanceta.
Guía para el Uso Adecuado de Guantes Sanitarios
Los guantes son una medida de prevención primaria contra riesgos biológicos. Aunque no previenen completamente las perforaciones, se ha demostrado que reducen significativamente el volumen de sangre transferida, disminuyendo así el riesgo de infecciones por agentes biológicos.
Por esta razón, los guantes son la barrera de protección más importante para evitar la contaminación con material biológico potencialmente infeccioso (como sangre, fluidos corporales, secreciones, membranas mucosas y piel no intacta de los pacientes), y reducen la probabilidad de transmisión de microorganismos del personal sanitario a los pacientes.
Los guantes cumplen una doble función:
- Proteger al trabajador de riesgos para su salud como Equipo de Protección Individual.
- Proteger a los pacientes de una posible transmisión de agentes biológicos portados por el usuario de los guantes.
Necesidad de Uso de Guantes según la Tarea
Cuándo “SÍ” se debe usar guantes, siendo necesaria también la higiene de manos:
- En procedimientos o técnicas sanitarias que impliquen contacto con sangre, tejidos y fluidos biológicos.
- Al manipular objetos, materiales o superficies contaminadas con sangre o fluidos biológicos.
- Al manejar lencería sucia, desechos u otros materiales.
- En curas de heridas y cualquier otro procedimiento invasivo que implique penetración quirúrgica en tejidos, órganos o cavidades.
- Al obtener muestras de sangre, realizar aspiraciones o intubaciones, o al colocar catéteres.
- En contacto con mucosas o con piel no intacta del paciente, o en procedimientos diagnósticos donde pueda salpicar sangre o fluidos corporales.
- Cuando se indique expresamente en un procedimiento, como en aislamientos hospitalarios por contacto.
- Al manipular agentes citostáticos (preparación, administración, limpieza de excretas, etc.).
- Al administrar medicación por vía intravenosa, subcutánea, intramuscular, endotraqueal e intraósea.
- En manipulaciones de productos químicos o contacto con residuos biosanitarios.
- En procedimientos que requieran técnica estéril.
Recordatorio Importante
El uso de guantes es obligatorio siempre que el trabajador sanitario presente cortes, heridas o lesiones cutáneas.
Durante su uso, es necesario cambiar los guantes:
- Al atender a diferentes pacientes.
- Al cuidar a un mismo paciente si es necesario pasar de una zona más contaminada a una más limpia.
- Al cambiar de actividad o procedimientos.
- En caso de sufrir una salpicadura, rotura o perforación de los guantes.
Recuerda que…
- Las manos deben lavarse o desinfectarse antes y después de usar guantes.
- Los guantes no deben ser lavados ni reutilizados.
- Los guantes deben usarse únicamente cuando sea necesario y por el tiempo imprescindible, ya que el uso excesivo de los mismos puede dar una falsa sensación de seguridad y aumentar la contaminación cruzada.
Cuándo “NO” es necesario utilizar guantes, siendo suficiente la higiene de manos:
- Durante los traslados de pacientes.
- Al repartir y recoger la comida.
- Al manipular material limpio.
- Al ajustar la fluidoterapia IV.
- Al cambiar o recoger ropa de cama, excepto cuando esté manchada con fluidos corporales.
- Durante el examen del paciente sin contacto con sangre, fluidos corporales o membranas mucosas (tomar constantes, realizar ECG, exploraciones radiológicas, etc.).
- Al tomar constantes y realizar exploraciones sobre piel intacta.
- Al administrar medicación por vía oral o cambiar goteros.
- Durante tratamientos de fisioterapia sobre piel intacta.
Pautas a seguir antes de utilizar guantes:
- Las manos deben estar libres de objetos como anillos, relojes, etc., ya que pueden romper el guante. Las manos deben estar sin cremas, las uñas cortas y sin esmalte para facilitar una buena limpieza de material potencialmente infeccioso.
- Realizar la higiene de manos.
Recuerda que…
El uso de guantes no sustituye el lavado de manos.
Colocación adecuada de guantes estériles
Cuando sea necesario usar guantes estériles, es importante colocarlos de manera que se mantenga su esterilidad. A continuación, se describe la técnica para ponérselos correctamente:
1. Preparación: Colocar los guantes en el campo estéril.
2. Colocación del primer guante: Tomar el primer guante por la zona más cercana a nosotros e introducir la mano correspondiente, teniendo cuidado de no tocar la zona que entrará en contacto con el paciente (la superficie exterior del guante).
3. Colocación del segundo guante: Introducir los dedos en el segundo guante según se indica en la fotografía. Esto evitará la contaminación del primer guante.
4. Finalización: Para completar la maniobra, introducir los dedos por la cara externa que quedó doblada y terminar de estirar el guante. De esta manera, no se producirá contaminación en ninguno de los guantes.
Retirada de los guantes
Es importante quitarse los guantes de manera correcta para evitar una posible contaminación del trabajador. A continuación, se describe la técnica para retirarlos:
1. Primer guante: Pellizcar por el exterior del primer guante.
2. Extracción: Retirar sin tocar la parte interior del guante.
3. Retirada completa: Retirar el guante en su totalidad.
4. Recogida: Recoger el primer guante con la otra mano.
5. Segundo guante: Retirar el segundo guante introduciendo los dedos por el interior.
6. Extracción final: Retirar el guante sin tocar la parte externa del mismo.
7. Descarte: Colocar los dos guantes en el contenedor adecuado.
Exposición a Contaminantes Biológicos
Los guantes de protección contra agentes biológicos deben asegurar impermeabilidad, máxima flexibilidad y alta sensibilidad para permitir su uso en cualquier tipo de tarea. Pueden estar fabricados con látex natural o con otros elastómeros como vinilo, nitrilo, polímeros sintéticos, etc. Y cuando sea necesario, serán estériles.

Exposición a Citostáticos y Otros Fármacos Peligrosos
Existe riesgo de exposición a citostáticos en tareas que implican contacto con este tipo de medicamentos:
- Preparación en cabina, en Farmacia.
- Administración de medicamentos citostáticos, contacto con excretas y/o lencería sucia de las unidades donde se administren citostáticos.
- Recogida de residuos y limpieza de derrames.
Para el uso de este tipo de guantes, se deben seguir las recomendaciones indicadas en el “Protocolo de Medicamentos Citostáticos u Otros Fármacos Peligrosos”. En general:
- Se debe cambiar los guantes al pasar de la administración de un paciente a otro, y en Farmacia, deben retirarse los guantes al salir de la cabina de preparación.
- Los guantes deben desecharse en un contenedor de residuos adecuado y correctamente señalizado.
¿Sabías que…?
El tipo de guante a utilizar para la manipulación y administración de citostáticos es el de nitrilo no estéril. Para la preparación en campana de citostáticos y ciertos fármacos, se utiliza un guante de cirugía estéril sin látex, hecho de polímero sintético.
Exposición a Productos Químicos
Existe un riesgo de exposición a productos químicos en tareas que implican contacto con estos, como en los servicios de laboratorio, anatomía patológica, radiología, etc.
En estos casos, el tipo de guante a usar depende del producto específico. Siempre se debe consultar la ficha de datos de seguridad del producto a utilizar. Se debe tener en cuenta que:
- En algunos casos, ciertos materiales que proporcionan buena protección contra unos productos químicos pueden no proteger adecuadamente contra otros.
- La mezcla de ciertos productos puede resultar en propiedades diferentes de las esperadas, basadas en el conocimiento de las propiedades individuales de cada uno.
Como norma general, es recomendable cambiar este tipo de guante con frecuencia.
Radiación Ionizante
Para tareas que impliquen trabajar bajo radiación, se deben utilizar guantes de atenuación radiológica. Se debe seguir las instrucciones del Servicio de Protección Radiológica del hospital.
Requisitos Normativos
Todos los guantes destinados a proteger contra uno o más riesgos deben cumplir una serie de requisitos legales y normas, y estar identificados con los pictogramas correspondientes.
Como Producto Sanitario (PS):
- Marcado CE conforme al RD 1591/2009. Clase 1. Declaración de conformidad, etc.
Como Equipo de Protección Individual (EPI):
- Marcado CE conforme al RD 1407/92. Categoría III. Declaración de conformidad, examen CE de tipo.
- Deben ser “Guantes de protección contra productos químicos y microorganismos”. CE + número del organismo de control notificado.
El cumplimiento de la legislación y normas requiere que los guantes estén identificados con una serie de pictogramas.
Efectos Adversos en el Uso de Guantes
Los problemas o efectos adversos más comunes asociados con el uso de guantes son:
Dermatitis de Contacto Irritativa
Es la forma más común de dermatitis y se caracteriza por la aparición de áreas irritadas en la piel. Esto puede ser causado por diversos factores o una combinación de ellos, tales como el lavado repetido de manos, un riesgo ocupacional en el entorno sanitario, la incorrecta técnica de lavado, secado e hidratación de manos, el uso de detergentes o el contacto con el polvo de los guantes.
Dermatitis Alérgica de Contacto
Es una reacción de hipersensibilidad retardada que aparece unos días después del contacto con el alérgeno y desaparece tras unos días sin contacto con este. Generalmente es causada por las sustancias químicas utilizadas en la fabricación de los guantes y el polvo empleado para facilitar su colocación.
Los aditivos con mayor potencial alérgeno incluyen: carbamatos (utilizados para dar elasticidad en guantes de látex y nitrilo), guanidinas, tiureas, tiazoles y tiuranos (usados como aceleradores en la fabricación de caucho), y parafenilendiaminas o PPD (utilizadas como antioxidantes).
Hipersensibilidad Inmediata
Son reacciones inmunológicas causadas por las proteínas del látex, que se manifiestan en pocos minutos tras el contacto con ellas. También puede provocar rinitis y asma debido a la inhalación de partículas de látex que pueden quedar suspendidas en el aire fijadas a las partículas de polvo que contienen los guantes.
Recuerda que…
Consulta con tu Unidad Básica de Prevención (Salud Laboral) si tienes alguna duda o presentas algún síntoma.


