Sistemas de Unidades en el Laboratorio
Una magnitud física es cualquier propiedad que puede medirse, como la longitud, la superficie o la masa.
Medir consiste en determinar una magnitud comparándola con otra que se toma como referencia.
El resultado de una medición siempre se expresa mediante un número acompañado de una unidad, ya que el número por sí solo no tendría significado. Además, las magnitudes solo pueden sumarse o restarse si están expresadas en las mismas unidades.
Errores en las Medidas
Errores Sistemáticos y Accidentales
Ninguna medición es completamente precisa, siempre existen errores que pueden clasificarse en:
- Errores sistemáticos: Son causados por el instrumento de medida, ya sea por defectos en su fabricación o por un uso inadecuado. Se pueden identificar y corregir utilizando diferentes métodos o cambiando el equipo de medición.
- Errores accidentales: Surgen por múltiples factores incontrolables. Para reducirlos, se recomienda realizar varias mediciones y calcular el valor medio.
Error Absoluto y Relativo
El impacto de un error depende del contexto. Un error de un gramo en una medición de pocos gramos es significativo, mientras que el mismo error al pesar toneladas es despreciable. Por ello, es útil considerar:
- Error absoluto: Diferencia entre el valor medido y el valor real de la magnitud.
- Error relativo: Relación entre el error absoluto y el valor real de la magnitud medida. Expresado en porcentaje, se obtiene el margen de error en la medición.
Ejemplo:
Si una pesa de referencia de 10 gramos es medida en una balanza con un resultado de 9,9996 gramos, los errores se calcularían así:
- Error absoluto: 10 – 9,9996 = 0,0004 g
- Error relativo: 0,0004 / 10 = 0,00004 (4 × 10⁻⁵)
- Porcentaje de error: 4 × 10⁻⁵ × 100 = 0,004 %
Sistemas de Unidades
Entre todas las magnitudes medibles, existen tres que se consideran fundamentales, ya que no pueden reducirse a otras y sirven como base para definir el resto de magnitudes derivadas.
Las unidades fundamentales se definen de manera precisa y son la base para expresar todas las demás magnitudes en términos más complejos.

Propiedades de las Magnitudes
- La relación entre las magnitudes fundamentales y las derivadas se expresa mediante su fórmula dimensional.
- Superficie: Se obtiene multiplicando dos longitudes, por lo que es una magnitud derivada de la longitud.
- Fórmula dimensional [S] = longitud × longitud = L²
- Unidad de superficie = metro cuadrado (m²)
- Volumen: Se obtiene multiplicando tres longitudes.
- Fórmula dimensional: [V] = longitud × longitud × longitud = L³
- Unidad de volumen: metro cúbico (m³)
- Velocidad (v): Se calcula dividiendo una longitud entre un tiempo.
- Fórmula dimensional: [v] = L / T (longitud / tiempo)
- Unidad de velocidad: metro por segundo (m/s)
- Densidad (D): Se obtiene dividiendo la masa entre el volumen.
- Fórmula dimensional: [D] = M / V (masa / volumen)
- Unidad de densidad: D = kilogramo por metro cúbico (kg/m³)
- Cuando dos mediciones tienen la misma fórmula dimensional, pertenecen a la misma magnitud y pueden sumarse si están en las mismas unidades.
- Ejemplo: Para sumar 4 m/s y 80 km/h, es necesario convertir los 4 m/s a km/h.
- Dado que los metros miden longitud y los segundos miden tiempo, la relación longitud/tiempo corresponde a una velocidad.
Sistema Internacional de Unidades
El Sistema Internacional de Unidades (SI) es el sistema oficial de medición adoptado a nivel internacional. Este sistema clasifica las unidades en dos categorías:
- Unidades básicas: Son aquellas que describen propiedades físicas fundamentales.
- Unidades derivadas: Se obtienen a partir de las unidades básicas mediante combinaciones matemáticas.
El SI se emplea en distintos ámbitos científicos y técnicos, asegurando uniformidad en las mediciones y facilitando la comunicación y comparación de resultados a nivel global.
se modifica los capítulos 1.2, II.3 y III.1.6, 2.8 y 9 del anexo, por Real Decreto 493/2020, de 28 de abril (Ref. BOE-A-2020-4707).
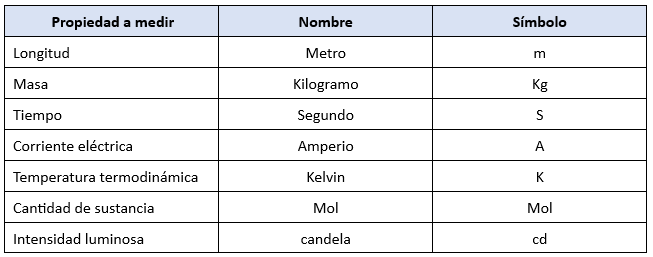
Definición de las Unidades Básicas del SI
a) Unidad de longitud (metro, m)
El metro se define como la distancia recorrida por la luz en el vacío durante un intervalo de 1/299 792 458 de segundo. Como resultado, la velocidad de la luz en el vacío es exactamente 299 792 458 m/s.
b) Unidad de masa (kilogramo, kg)
El kilogramo es la unidad de masa y equivale a la masa del prototipo internacional del kilogramo, adoptado en la Conferencia General de Pesas y Medidas de 1901.
c) Unidad de tiempo (segundo, s)
El segundo se define a partir de 9 192 631 770 oscilaciones de la radiación emitida en la transición entre los niveles hiperfinos del estado fundamental del átomo de cesio-133. Esta definición se basa en un átomo de cesio en reposo a temperatura 0 K.
d) Unidad de intensidad de corriente eléctrica (amperio, A)
El amperio es la corriente constante que, al circular por dos conductores paralelos de longitud infinita y sección despreciable, separados por 1 metro en el vacío, genera una fuerza de 2 × 10⁻⁷ newton por metro de longitud.
e) Unidad de temperatura termodinámica (kelvin, K)
El kelvin se define como la fracción 1/273,16 de la temperatura del punto triple del agua, con una composición isotópica específica. La temperatura termodinámica del punto triple del agua es exactamente 273,16 K.
f) Unidad de cantidad de sustancia (mol, mol)
El mol representa la cantidad de sustancia que contiene el mismo número de entidades elementales que hay en 0,012 kg de carbono-12. Las entidades elementales pueden ser átomos, moléculas, iones o partículas específicas.
g) Unidad de intensidad luminosa (candela, cd)
La candela es la intensidad luminosa de una fuente que emite radiación monocromática de frecuencia 540 × 10¹² hercios, con una intensidad energética de 1/683 vatios por estereorradián.
Gravimetría
Introducción
Los métodos gravimétricos son de los más antiguos en química analítica, pero siguen siendo relevantes en la actualidad. Son fundamentales en el control de calidad de medicamentos y productos de uso humano. Cuando se combinan con técnicas modernas de separación, como la cromatografía de gases, permiten realizar análisis cualitativos y cuantitativos con gran precisión.
La gravimetría se basa en la cuantificación de la masa o concentración del analito mediante la pesada del producto resultante de una reacción estequiométrica.
El análisis gravimétrico consiste en separar y pesar un compuesto puro cuya composición se conoce, el cual está relacionado de manera definida con la sustancia que se desea medir.
Dado que la masa es una magnitud común a todas las especies químicas, es necesario realizar separaciones lo más exactas posibles para garantizar la selectividad del método. Aunque estos procedimientos suelen ser sencillos y proporcionar resultados muy precisos, requieren un control continuo, ya que no son fácilmente automatizables.
Dato clave:
La balanza analítica es el instrumento más utilizado en gravimetría debido a su precisión y exactitud, permitiendo determinar la masa con gran fiabilidad.
Tipos de Análisis Gravimétrico
Los métodos gravimétricos se basan en la medición del peso de un sólido seco que corresponde al analito o a un compuesto relacionado estequiométricamente con él. Generalmente, este tipo de análisis se fundamenta en una reacción química representada como:
a A + r R → AₐRᵣ
Donde A representa el analito que se desea determinar y R es el reactivo, el cual puede ser una sustancia química o incluso una corriente eléctrica en métodos electrogravimétricos. El producto AₐRᵣ es un compuesto poco soluble que, tras su secado, puede pesarse directamente o ser sometido a calcinación para formar otro compuesto de composición definida antes de la medición.
Para reducir la solubilidad del precipitado, es común añadir un exceso del reactivo R. Un método gravimétrico óptimo debe cumplir con los siguientes requisitos:
- El proceso de separación debe ser completo, asegurando que la cantidad de analito no precipitada sea insignificante desde el punto de vista analítico.
- El compuesto obtenido debe tener una composición definida y ser lo más puro posible, ya que impurezas pueden alterar los resultados. Garantizar la pureza es un desafío clave en este tipo de análisis.
Si bien la solubilidad del precipitado puede causar errores menores, el principal desafío radica en obtener precipitados que sean puros y fáciles de filtrar. A lo largo del tiempo, se han desarrollado estudios sobre la formación y las propiedades de los precipitados para minimizar el riesgo de contaminación.
Cálculos Generales en Análisis Gravimétrico
Los cálculos gravimétricos se basan en los pesos atómicos y moleculares, así como en la relación estequiométrica de las reacciones químicas.
Cálculos Estequiométricos
En estos procedimientos, se determina el peso del precipitado y, a partir de este dato, se calcula la cantidad de analito presente en la muestra. El porcentaje de analito A en la muestra se obtiene con la siguiente expresión:
% A = (masa del analito / masa de la muestra) × 100
Para facilitar los cálculos, se emplea el factor gravimétrico, que indica cuántos gramos del analito están presentes en cada gramo del precipitado. La cantidad de analito se calcula con:
Peso del analito = masa del precipitado × factor gravimétrico
Por lo tanto, la expresión completa para el cálculo del porcentaje del analito en la muestra es:
% A = (masa del precipitado × factor gravimétrico) / (masa de la muestra) × 100
El factor gravimétrico surge de manera natural a partir de la relación estequiométrica entre las sustancias involucradas en la reacción química.
Factores Gravimétricos
El factor gravimétrico, también conocido como factor químico, representa la cantidad de una sustancia de interés que equivale a una cantidad dada de otra sustancia pesada en el análisis.
Para determinar los factores gravimétricos, se siguen las siguientes reglas:
- El numerador del factor gravimétrico debe corresponder al peso atómico o molecular de la sustancia que se busca cuantificar.
- El denominador representa el peso de la sustancia pesada en el análisis.
- Solo se consideran las sustancias inicial y final en el cálculo del factor, sin tomar en cuenta compuestos intermedios generados en la reacción química.
- El número de veces que los pesos atómicos o moleculares aparecen en el numerador y el denominador debe reflejar la estequiometría de la reacción química involucrada.
El uso de factores gravimétricos facilita los cálculos en análisis repetidos de un mismo compuesto, optimizando el proceso de determinación del analito en diversas muestras.
Métodos de Análisis Gravimétrico
Dado que la etapa más crítica en los métodos gravimétricos es la separación del compuesto, estos se clasifican según el procedimiento utilizado para llevar a cabo dicha etapa.

Métodos de Precipitación Química
En estos métodos, el analito se transforma en un precipitado poco soluble, que posteriormente se filtra, purifica y se convierte en un compuesto de composición conocida mediante tratamiento térmico antes de su pesaje. A partir de este peso, se determina la cantidad original del analito presente en la muestra.
Para que el proceso sea efectivo, la precipitación debe cumplir con ciertas condiciones:
- Selectividad: La sustancia que precipita debe ser exclusivamente la que se busca analizar.
- Completitud: Se debe garantizar que la precipitación sea lo más completa posible, minimizando la solubilidad del precipitado.
- Facilidad de filtrado: El precipitado debe tener un tamaño de partícula adecuado para facilitar su separación y eliminación de impurezas.
- Estabilidad química: No debe reaccionar con otras sustancias y su composición debe permanecer constante tras el secado o calcinado.
Para lograr una precipitación selectiva, se emplean reactivos específicos o se ajustan condiciones como el pH, la eliminación de interferencias o la presencia de agentes complejantes.
Para obtener partículas de mayor tamaño y reducir impurezas, se deben agregar reactivos lentamente y con agitación, además de trabajar con soluciones diluidas y temperaturas elevadas para favorecer el crecimiento de cristales en lugar de partículas coloidales.
Si la solubilidad del precipitado es muy baja, se puede recurrir a la precipitación en disolución homogénea, donde el reactivo precipitante se genera gradualmente dentro de la solución.
Métodos de Precipitación Electroquímica (Electrogravimetría)
Estos métodos se basan en la deposición del analito en un electrodo mediante un proceso electroquímico. El constituyente a determinar se deposita sobre el electrodo en su forma elemental tras una reacción redox, permitiendo su cuantificación por diferencia de peso antes y después del proceso.
Métodos de Extracción Gravimétrica
Estos métodos se basan en la distribución del soluto entre disolventes inmiscibles. El analito reacciona con un reactivo adecuado y es extraído con un disolvente específico.
Tras la extracción, el disolvente se elimina y se pesa el producto obtenido. Una ventaja de este método es que minimiza problemas de contaminación asociados a la precipitación.
Métodos de Volatilización Gravimétrica
Se emplean para medir componentes de la muestra que pueden volatilizarse.
- Método directo: El analito se evapora y se hace pasar a través de una sustancia absorbente previamente pesada. La ganancia de peso del absorbente corresponde al analito volatilizado.
- Método indirecto: Se volatiliza el analito y se pesa el residuo restante. La pérdida de masa indica la cantidad de analito volatilizado.
Estos métodos son útiles cuando el analito es la única sustancia volátil en la muestra o cuando se dispone de un absorbente selectivo para la sustancia de interés.
El producto volatilizado se puede cuantificar directamente mediante pesaje o de manera indirecta a partir de la pérdida de masa de la muestra inicial.
Otros Métodos Gravimétricos
Existen otras técnicas utilizadas en análisis gravimétrico, como los métodos de sedimentación, flotación y aquellos que aprovechan propiedades magnéticas para la separación y cuantificación del analito.
Método Gravimétrico de Precipitación
Este método es uno de los más utilizados en análisis gravimétrico. Consiste en preparar una solución que contiene el analito y agregar un agente precipitante, que reacciona con el analito para formar un compuesto de baja solubilidad. Luego, el precipitado se separa de la solución utilizando técnicas como la decantación o el filtrado. Posteriormente, el sólido precipitado se seca en un horno o estufa para eliminar la humedad residual y, finalmente, se pesa. La cantidad de analito en la muestra original se determina en función de la reacción química y la relación estequiométrica con el agente precipitante.
Para aplicar este método, el analito debe cumplir con ciertos requisitos:
- Baja solubilidad, para garantizar una separación eficiente.
- Alta pureza, para minimizar impurezas en la medición final.
- Facilidad de filtración, para una separación efectiva.
- Composición química estable, para asegurar la precisión de los resultados.
Clasificación de las Partículas del Precipitado
El tamaño de las partículas del precipitado depende de la naturaleza del compuesto y de las condiciones experimentales bajo las que se forma. Cuando se excede el producto de solubilidad de un compuesto, los iones comienzan a unirse y formar una red cristalina que crece hasta alcanzar un tamaño suficiente para ser sedimentado por la gravedad.
Se considera que una partícula debe tener un diámetro superior a 10⁻⁴ cm para precipitarse de manera efectiva en una solución.
Tipos de Precipitado
Según su tamaño, los precipitados pueden clasificarse en:
- Coloidales: Tienen un tamaño del orden de micrómetros (µm), no sedimentan fácilmente y no pueden filtrarse con métodos comunes. Se dividen en:
- Sistemas hidrófobos: Precipitan al agregar un electrolito. Son irreversibles y presentan baja viscosidad. Ejemplos: oro, azufre, yoduro de plata.
- Sistemas hidrofílicos: Poseen afinidad por el disolvente, alta viscosidad y son reversibles. También conocidos como geles. Ejemplos: almidón y proteínas.
- Cristalinos: Tienen un tamaño en el rango de milímetros (mm), sedimentan con facilidad y pueden filtrarse con una variedad de métodos.
Factores que Influyen en el Tamaño de las Partículas
El tamaño de las partículas del precipitado está determinado por:
- Solubilidad del precipitado en el medio.
- Temperatura de la solución.
- Concentración de reactivos utilizados.
- Velocidad de mezcla de los reactivos.
Estos factores afectan el grado de sobresaturación relativa (SR), que describe la diferencia entre la concentración instantánea y la solubilidad de equilibrio del soluto en la solución. Se expresa mediante la ecuación:
Sr = (Q – S) / S
Donde:
- S: Solubilidad del precipitado en el medio.
- Q: Concentración de soluto en cualquier instante en el medio.
Una mayor concentración del agente precipitante genera una mayor sobresaturación, lo que resulta en partículas de menor tamaño.
Etapas de Formación del Precipitado
El proceso de precipitación consta de dos fases principales:
- Nucleación: Se forman pequeños núcleos de precipitado, compuestos por pocas partículas de la sustancia precipitada. La velocidad de nucleación se expresa como:Vn = K (Q – S)ⁿ, donde n > 1
- Crecimiento: Los iones de la solución se depositan sobre los núcleos ya formados, generando partículas de mayor tamaño.Vc = K A (Q – S), donde A es el área superficial de los núcleos existentes.
El equilibrio entre nucleación y crecimiento determina la morfología final del precipitado, siendo clave para obtener partículas de tamaño adecuado para su filtración y análisis.
Medidas para Favorecer el Crecimiento de las Partículas en un Precipitado
- Aumentar la temperatura, ya que favorece la solubilidad y mejora la formación de partículas más grandes.
- Agregar el reactivo precipitante lentamente y con agitación, evitando la sobresaturación local.
- Utilizar grandes volúmenes de disolución con baja concentración de analito y precipitante, lo que contribuye a una formación controlada del precipitado.
Pureza de los Precipitados
Aunque se busca que los precipitados sean lo más puros posible, es difícil lograr una pureza absoluta. Es importante identificar y minimizar las fuentes de contaminación durante la formación del precipitado.
Coprecipitación
Este fenómeno ocurre cuando una sustancia soluble se incorpora al precipitado, lo que puede alterar la precisión del análisis.
Tipos de Coprecipitación:
- Adsorción en la superficie: Se produce cuando iones solubles quedan atrapados en la superficie del precipitado.
- Solución: Disolver y reprecipitar el compuesto para eliminar impurezas.
- Formación de cristales mixtos: Se da cuando un ion en la red cristalina del precipitado es reemplazado por otro ion similar.
- Solución: Utilizar un reactivo precipitante diferente.
- Oclusión y atrapamiento mecánico: Impurezas quedan atrapadas dentro de los cristales formados.
- Solución: Reducir la velocidad de formación del precipitado o disolverlo y volver a precipitarlo.
Métodos para Corregir Errores por Coprecipitación:
- Adición de reactivos: Controla la concentración de impurezas y la carga de las partículas en suspensión.
- Lavado del precipitado: Se utiliza en precipitados gelatinosos, añadiendo un electrolito para evitar la redisolución.
- Digestión: Favorece la pureza del precipitado cristalino.
- Reprecipitación: Se emplea en casos donde el precipitado se disuelve fácilmente, permitiendo eliminar impurezas.
- Separación previa: Se realiza antes de la precipitación para eliminar interferencias.
- Precipitación homogénea: Se controla la formación del precipitado evitando zonas de alta concentración.
- Postprecipitación: Ocurre cuando una impureza se deposita sobre el precipitado después de su formación. Para evitarlo, se recomienda filtrar inmediatamente.
Operaciones Generales en el Análisis Gravimétrico
El análisis gravimétrico sigue una serie de etapas clave:
- Muestreo y preparación de la muestra.
- Pesada de la muestra.
- Disolución del analito.
- Preparación de la disolución para la precipitación.
- Precipitación del analito.
- Digestión del precipitado.
- Filtración.
- Lavado del precipitado.
- Tratamiento térmico para eliminar humedad.
- Pesada final del precipitado.
- Cálculos para determinar la cantidad del analito.
Las primeras tres etapas son comunes a la mayoría de los métodos analíticos. A continuación, se describen algunas fases esenciales:
Preparación de la Muestra
En muchos casos, la muestra no requiere un tratamiento previo. Sin embargo, si es sólida, puede necesitar disolverse mediante métodos adecuados. Además, se deben eliminar interferencias a través de ajustes en el pH o el uso de agentes enmascarantes para evitar precipitaciones no deseadas. El volumen de la muestra debe ser suficiente para generar una cantidad medible de precipitado.
Precipitación
Para obtener un precipitado de calidad, se deben cumplir ciertas condiciones:
- Uso de un agente precipitante adecuado.
- La reacción debe ser completa, asegurando que todo el analito precipite.
- El precipitado debe ser insoluble, con una solubilidad menor a 10⁻⁵ para minimizar pérdidas durante el lavado.
- Debe ser selectivo, evitando interferencias.
Existen varios enfoques para la precipitación, entre ellos:
- A partir de disoluciones diluidas.
- A partir de disoluciones concentradas.
- En fase homogénea, donde el precipitante se genera dentro de la solución.
Digestión del Precipitado
Este proceso es útil en precipitados cristalinos y en algunos casos en precipitados coagulados, pero no es recomendable para precipitados gelatinosos. La digestión permite mejorar la estructura del precipitado, facilitando su filtración y reduciendo impurezas.
Filtrado y Lavado
Filtración
El objetivo de la filtración es separar la fase líquida del sólido precipitado. Sin embargo, este proceso no es solo una separación mecánica, sino que también involucra fenómenos superficiales que influyen en el comportamiento del precipitado, tales como:
- Hidratación
- Adsorción
- Efecto electrocinético
- Influencia del propio precipitado
Existen diferentes métodos de filtración, entre ellos:
- Filtración con papel: Se utiliza en la mayoría de los análisis gravimétricos.
- Filtración con placas: Permite un proceso más rápido y eficiente, facilitando el lavado del precipitado. Sin embargo, no es recomendable para precipitados gelatinosos y, si se emplean placas de vidrio, pueden no resistir la temperatura de calcinación.
Lavado
El lavado tiene la finalidad de eliminar impurezas residuales. Es una de las etapas más delicadas en gravimetría, ya que el líquido utilizado no debe ser volátil para evitar modificaciones en la estructura del precipitado o su dispersión en forma coloidal.
Algunas soluciones de lavado recomendadas incluyen:
- Soluciones no volátiles: Agua, disolventes orgánicos, ácidos, sales aniónicas y amoníaco (único álcali permitido).
- Soluciones que no alteran la superficie del precipitado: Agua (excepto en presencia de perclorato y acetato de uranilo), disolventes orgánicos como acetona, metanol y alcoholes de alto peso molecular.
El líquido de lavado debe aplicarse en varias porciones pequeñas para garantizar la eliminación completa de impurezas. La eficacia del lavado se verifica químicamente, observando si el filtrado reacciona con un reactivo adicional, lo que indicaría la presencia de residuos del agente precipitante.
Métodos comunes de lavado:
- Lavado con agua: Remueve el agente precipitante y la mayoría de los contaminantes.
- Lavado con electrolitos: Se usa en precipitados coloidales coagulados para evitar la dispersión del coloide.
Secado y Calcinación
Después de la filtración y el lavado, el precipitado debe secarse o calcinase hasta alcanzar una composición estable, asegurando la eliminación de la humedad residual y otros compuestos volátiles.
El secado se realiza generalmente en una estufa a temperaturas entre 100 y 150 °C, o utilizando un mechero o llama abierta. Este proceso es adecuado para eliminar agua débilmente retenida, pero si el agua está químicamente adsorbida o atrapada en el precipitado, pueden ser necesarias temperaturas más elevadas.
Solubilidad: Conceptos Generales
Las reacciones de precipitación ocurren cuando un compuesto poco soluble se forma en una solución iónica. Estas reacciones son importantes tanto en el análisis químico como en la producción industrial, ya que permiten separar y purificar sustancias.
La disolución de un sólido ocurre cuando los iones de su estructura cristalina interactúan con las moléculas del disolvente, debilitando las fuerzas que los mantienen unidos. Este proceso está influenciado por factores como la concentración del soluto y la temperatura del medio.
Con el tiempo, la concentración de la solución alcanza un punto de equilibrio donde las partículas en disolución y en estado sólido permanecen constantes, lo que define una disolución saturada. Este equilibrio se representa como:
SOLUTO (sólido) ⇌ SOLUTO (disuelto)
La cantidad máxima de soluto que puede disolverse en un volumen específico de disolvente se conoce como solubilidad, la cual es una propiedad física característica de cada sustancia y depende principalmente de la temperatura.
- En la mayoría de los casos, la solubilidad aumenta con la temperatura, facilitando la disolución de sólidos en líquidos.
- En el caso de los gases, la solubilidad generalmente disminuye con la temperatura y aumenta con la presión.
C = KP
La relación entre la solubilidad y la presión de un gas en un líquido sigue la Ley de Henry, la cual establece que la cantidad de gas disuelto en un líquido es proporcional a la presión parcial del gas sobre el líquido.
Este principio es fundamental en procesos químicos, industriales y en el comportamiento de los gases en sistemas biológicos.
Factores que Influyen en la Solubilidad
Cuando un compuesto iónico se disuelve en agua, eventualmente se alcanza un punto de equilibrio en el que la disolución se satura AB ⇌. Este equilibrio puede expresarse mediante la siguiente ecuación:
K = (A⁺) + (B⁻) /(AB)
Dado que la constante de equilibrio de un proceso químico varía con la temperatura, la solubilidad de una sustancia también se ve afectada por cambios térmicos. Si a una disolución saturada se le añade un soluto, su impacto en la solubilidad dependerá de su naturaleza:
- Si el soluto no tiene iones en común con la sustancia disuelta, su efecto sobre la solubilidad será mínimo. En algunos casos, puede aumentar ligeramente si la fuerza iónica del medio se incrementa.
- Si el soluto reacciona formando un complejo con la sustancia en disolución, esto puede aumentar su solubilidad.
- Si el soluto contiene un ion en común con la sustancia disuelta, la solubilidad disminuirá debido a un desplazamiento del equilibrio, favoreciendo la formación del sólido precipitado.
Producto de Solubilidad y Aplicaciones
Para una sustancia poco soluble en agua, como AB, que se disocia en A⁺ y B⁻, la constante de equilibrio de su disolución se expresa como:
K = [A⁺][B⁻] / [AB]
Como la concentración de la sustancia no disuelta es constante, se define el producto de solubilidad (Kps) como el producto de las concentraciones de los iones en una disolución saturada:
K = [A⁺] [B⁻]/constante
Este concepto es esencial en química analítica y en la predicción de precipitaciones. A partir del producto de solubilidad, se pueden distinguir tres escenarios:
- Si el producto de las concentraciones iónicas es mayor que el K, se forma un precipitado.
- Si el producto de las concentraciones iónicas es menor que el K, el precipitado se disuelve.
- Si el producto de las concentraciones iónicas es igual al K, la disolución se encuentra en equilibrio y está saturada.
El efecto del ion común se usa para facilitar la precipitación de una sustancia. Cuando se añade un exceso de un ion presente en la sal poco soluble, su solubilidad disminuye, favoreciendo la formación del precipitado. En contraste, el efecto salino ocurre cuando se agregan otros iones al medio, lo que generalmente aumenta la solubilidad del precipitado.
Estos principios tienen aplicaciones prácticas en la separación de sulfuros ajustando el pH o en la disolución de carbonatos insolubles con ácidos.
Disolución de Precipitados
Para disolver un precipitado, es necesario reducir la concentración de uno de sus iones constituyentes. Existen varias estrategias para lograrlo:
- Reacción con ácidos débiles: Si el precipitado contiene un anión básico, se puede agregar un ácido débil que reaccione con él, formando una sustancia soluble.
- Interacción con amonio: Algunos hidróxidos insolubles pueden disolverse agregando iones NH₄⁺, que reaccionan con OH⁻, reduciendo su concentración y favoreciendo la disolución del precipitado.
- Uso de agentes oxidantes: Algunos compuestos, como los sulfuros metálicos, pueden resistir la acción de los ácidos, pero se disuelven en presencia de un oxidante fuerte. Por ejemplo, el ácido nítrico caliente oxida el sulfuro a azufre elemental, permitiendo la disolución del precipitado.
- Formación de complejos: En muchos casos, la solubilidad de un compuesto puede aumentar mediante la formación de iones complejos, que reducen la concentración de los iones libres y facilitan la disolución del sólido.
Estos métodos son ampliamente utilizados en análisis químicos y en procesos industriales donde es necesario disolver o separar compuestos específicos de una mezcla.
Instrumental Utilizado en el Proceso Gravimétrico
Durante el análisis gravimétrico, se emplean diversos instrumentos para llevar a cabo cada etapa del procedimiento:
- Morteros: Para pulverizar muestras sólidas.
- Balanzas analíticas y pesas de calibración: Para medir con precisión la masa de la muestra.
- Reactivos: Sustancias utilizadas en el proceso químico.
- Recipientes para pesar: Contenedores específicos para el pesaje de muestras.
- Vasos de precipitado: Para disolver y mezclar reactivos.
- Matraz Erlenmeyer: Usado en procesos de disolución y reacciones controladas.
- Embudo: Facilita la filtración y manipulación de líquidos.
- Papel de filtro: Permite separar sólidos de líquidos en la filtración.
- Pinzas: Para manipular objetos calientes o pequeños con precisión.
- Desecador: Se usa para evitar la absorción de humedad en las muestras secas.
- Estufa: Para secado y tratamiento térmico de los precipitados.
- Mufla: Para calcinación de muestras a altas temperaturas.
- Vidrios de reloj: Utilizados para cubrir recipientes y prevenir pérdidas de material.
- Muestras patrón: Referencias utilizadas para calibrar y validar el análisis.
Etapas del Proceso Gravimétrico
1. Preparación de la Muestra
Si la muestra es sólida, debe reducirse de tamaño mediante pulverización. Para ello, se utilizan morteros de porcelana o ágata. Los de porcelana pueden absorber parte de la muestra, mientras que los de ágata permiten triturar muestras pequeñas sin absorber el material.
2. Pesado de la Muestra
Una vez preparada, se pesa con precisión una cantidad adecuada, generalmente entre 1 y 3 gramos, dependiendo de la cantidad de constituyente que se desee determinar. Se emplean balanzas analíticas para garantizar la exactitud de la medición.
3. Disolución de la Muestra
Si la naturaleza de la muestra es desconocida, se recomienda un análisis cualitativo previo para identificar sus componentes y su solubilidad. Si la muestra es soluble en agua, se disuelve en un vaso de precipitado con un volumen adecuado de disolvente. Puede utilizarse agua fría o caliente, dependiendo de la sustancia. En caso de que la muestra sea insoluble en agua, se emplean reactivos específicos para su disolución, utilizando un vaso de precipitado o un matraz Erlenmeyer. Se pueden agregar ácidos o bases según sea necesario, asegurando una correcta reacción y evitando salpicaduras mediante el uso de un vidrio de reloj o un embudo. El objetivo de este tratamiento es convertir compuestos insolubles en sales solubles.
4. Precipitación
Este proceso es fundamental y consiste en transformar el analito en un compuesto insoluble dentro de una solución. Se debe asegurar que la precipitación sea completa para permitir una separación eficiente.
Para lograr una precipitación efectiva:
- Se calienta la solución hasta una temperatura cercana a la ebullición.
- Se agrega el reactivo precipitante de manera gradual y con agitación constante.
- Se deja resbalar el reactivo por las paredes del recipiente para evitar pérdidas por salpicadura.
- Se emplea un ligero exceso de reactivo para garantizar la completa precipitación del analito.
La formación del precipitado ocurre a partir de pequeños núcleos que crecen progresivamente con la adición del reactivo. En algunos casos, la aparición del precipitado no es inmediata y requiere un tiempo adicional para su formación. Sustancias como algunos fosfatos y oxalatos dobles pueden tardar en precipitar completamente.
Algunas muestras deben someterse a un proceso de digestión, manteniéndolas a temperatura controlada por un tiempo prolongado, preferentemente en caliente pero sin alcanzar el punto de ebullición. Este paso permite mejorar la pureza del precipitado y facilita su filtración en etapas posteriores.
Reglas Generales para la Precipitación
Antes de llevar a cabo un análisis gravimétrico, es importante seleccionar cuidadosamente el método más adecuado y asegurarse de disponer de los reactivos, materiales y utensilios necesarios. También es útil conocer la composición cualitativa de la muestra a analizar.
Para lograr una precipitación eficiente:
- Los agentes precipitantes deben añadirse lentamente y con agitación constante para favorecer la formación de cristales grandes.
- Se recomienda realizar la precipitación en caliente, cerca del punto de ebullición, mientras se agita con una varilla de vidrio y se agrega el reactivo precipitante gota a gota.
- Es fundamental añadir un ligero exceso del reactivo precipitante (entre 5 % y 10 %) para aumentar la solubilidad del precipitado, reducir la sobresaturación y mejorar la coagulación. Esto previene la formación de coloides y favorece la cristalización.
- Se debe permitir que el precipitado repose primero en caliente y luego en frío para asegurar su correcta formación.
- La filtración debe realizarse por decantación, lavando primero en el vaso y luego en el filtro.
- No se recomienda dejar un precipitado sin filtrar de un día para otro, ya que esto puede aumentar el riesgo de contaminación.
Tipos de Precipitados
Los precipitados pueden clasificarse según sus características físicas:
- Cristalinos: Formados por partículas regulares, lisas y brillantes, similares a la sal o el azúcar. Son los más deseables, ya que sedimentan fácilmente y permiten una filtración eficiente.
- Granulares: Partículas de forma irregular y superficie lisa, similares a los sedimentos de café. Aunque son fáciles de filtrar y lavar, tienden a ser porosas.
- Finamente divididos: Partículas extremadamente pequeñas, similares a la harina. No son deseables debido a su dificultad para ser filtrados.
- Gelatinosos: Forman una masa pegajosa con una textura similar a la gelatina. Son difíciles de filtrar y retienen impurezas, lo que dificulta su lavado.
Etapas de la Precipitación
- Formación de una solución sobresaturada.
- Agrupación de iones, que se combinan para formar los núcleos del precipitado insoluble.
- Crecimiento espontáneo, donde las partículas coloidales evolucionan hasta alcanzar un tamaño visible.
Filtración y Lavado del Precipitado
La filtración permite separar un sólido de un líquido mediante un medio filtrante. Para ello, se pueden emplear:
Crisoles
- De vidrio: Poseen fondo poroso y son adecuados para filtrar precipitados granulares y cristalinos a temperaturas entre 110°C y 250°C.
- De Gooch: Especialmente diseñados para precipitados que requieren calentamiento a temperaturas elevadas.
Papeles de Filtro Whatman
Estos filtros están diseñados para análisis gravimétricos y preparación de muestras para análisis instrumentales. Se encuentran en tres formatos:
- Sin cenizas: Con un contenido de cenizas máximo del 0,007 %, ideales para procedimientos analíticos críticos.
- Endurecidos con bajo contenido de cenizas: Resistentes a la humedad y productos químicos, adecuados para filtración en embudos Büchner.
- Endurecidos sin cenizas: Tratados con ácido para mayor resistencia química y con un contenido de cenizas extremadamente bajo.
Condiciones del Filtrado
- Se debe seleccionar un papel de filtro con el tamaño y características adecuadas para la muestra. Si se va a calcinizar el papel, debe elegirse uno sin cenizas.
- Para el lavado del precipitado, es preferible utilizar una solución diluida con un ion común al precipitado en lugar de agua pura.
- Se recomienda emplear la menor cantidad posible de solución de lavado, distribuyéndola en varias porciones pequeñas para una mayor eficacia en la eliminación de impurezas.
Secado del Precipitado
El secado permite obtener el peso seco de un precipitado y calcular la cantidad de sustancias volátiles presentes. Para ello:
- Se emplea una cápsula de fondo plano desecada por calor en estufa a 105°C y posteriormente enfriada en un desecador.
- Se pesa una cantidad determinada de muestra y se calienta en la estufa a 105°C durante 30 minutos.
- Se retira y se deja enfriar en el desecador antes de pesar nuevamente.
- Se repite el proceso hasta alcanzar un peso constante, asegurando que la diferencia entre dos pesadas consecutivas sea menor al 0,05 %.
El contenido de humedad y sustancias volátiles se calcula con la siguiente fórmula:
% Humedad y Materias Volátiles = 100 × (Pa – Pf) / PM
Donde:
- Pa = Peso de la cápsula con la muestra sin calentar.
- Pf = Peso de la cápsula con la muestra tras la desecación.
- PM = Peso de la muestra inicial.
Calcinación
La calcinación se emplea para obtener cenizas, que representan el residuo mineral de un producto tras su incineración. Se lleva a cabo en un horno de alta temperatura y se utiliza para determinar el contenido mineral de una muestra luego de eliminar la materia orgánica.
Procedimiento para la Obtención de Cenizas
El proceso de calcinación consiste en calentar una cantidad medida de muestra en una cápsula de incineración. Primero, se calienta de manera moderada en un baño de agua para iniciar la evaporación, luego se utiliza un baño de arena y finalmente se somete a calentamiento en un horno mufla a temperaturas entre 400 y 550°C. Posteriormente, se añade agua a la muestra y se repite el proceso de evaporación y calcinación.
Una vez completada la calcinación, las cenizas obtenidas se pesan en la misma cápsula utilizada para su tratamiento. El contenido de cenizas se calcula con la siguiente fórmula:
Cenizas (%) = 100 × P’ / P
Donde:
- P = Peso inicial de la muestra en gramos.
- P’ = Peso de las cenizas obtenidas en gramos.
Para asegurar una calcinación uniforme, la temperatura en la mufla no debe superar los 600°C. Es importante no abrir el horno hasta que la temperatura descienda a 100°C. El tiempo estimado para la calcinación es de aproximadamente 20 minutos.
Enfriado
Después de la calcinación, las muestras deben enfriarse en un desecador con la tapa cerrada para evitar la absorción de humedad. Se recomienda un tiempo de enfriamiento de 30 minutos.
Pesado
El pesaje se realiza en una balanza analítica, considerando el peso inicial del papel de filtro y el número de filtros utilizados.
Balanza Analítica
La balanza analítica es un instrumento utilizado para medir pequeñas masas con gran precisión. Es uno de los dispositivos más importantes en el laboratorio, ya que la precisión de los resultados analíticos depende en gran medida de su correcto funcionamiento.
Las balanzas modernas pueden ofrecer lecturas con precisiones desde 0.1 µg hasta 0.1 mg. Aunque el uso de circuitos electrónicos ha mejorado su precisión, aún pueden verse afectadas por factores ambientales como la humedad y la temperatura.
Características de una Balanza Analítica
- Exactitud en la medición.
- Estabilidad para obtener resultados confiables.
- Alta sensibilidad a cambios mínimos de masa.
- Período de oscilación controlado para evitar demoras innecesarias en la lectura.
Factores que Afectan la Medición en una Balanza Analítica
1. Adsorción de Humedad
Algunas sustancias pueden absorber humedad del ambiente, afectando su peso. Para evitar este problema, se recomienda:
- Usar crisoles de porcelana calcinados, ya que no retienen humedad de manera significativa.
- Emplear recipientes herméticos para pesar sustancias higroscópicas.
2. Electrificación de los Recipientes
La acumulación de carga estática en los recipientes de vidrio puede generar errores en la medición. Para prevenirlo, se pueden tomar las siguientes acciones:
- Aumentar la humedad relativa del ambiente (idealmente entre 45% y 60%).
- Exponer el recipiente a luz ultravioleta o a una descarga eléctrica de alta frecuencia.
- Conectar la balanza a un sistema de tierra eficiente.
3. Variaciones de Masa
El peso de una muestra puede fluctuar debido a:
- Absorción de humedad del ambiente.
- Evaporación de compuestos volátiles.
Para minimizar estos efectos, se recomienda:
- Usar frascos secos y limpios.
- Mantener la superficie de la balanza libre de polvo y contaminantes.
- Utilizar frascos con cuellos estrechos y tapas herméticas.
4. Diferencias de Temperatura
Si una muestra está más caliente que la balanza, parecerá más ligera debido a las corrientes de convección. Para evitar errores:
- No pesar muestras recién retiradas de estufas, muflas o refrigeradores.
- Dejar que la muestra alcance la temperatura del laboratorio antes de pesarla.
- Manipular los frascos con pinzas en lugar de las manos.
5. Magnetismo
Los materiales ferromagnéticos, como el hierro y el acero, pueden ser atraídos por el plato de la balanza, causando lecturas erróneas. Para evitar este problema:
- Desmagnetizar las muestras si es posible.
- Separar la muestra del plato utilizando soportes no magnéticos.
- Utilizar el gancho superior de la balanza si está disponible.
6. Variaciones en la Gravedad
La fuerza gravitacional varía según la ubicación geográfica y la altitud. Cuanto más cerca del ecuador, menor será la atracción gravitacional debido a la fuerza centrífuga. Además, a mayor altitud, la gravedad disminuye.
Para mediciones de alta precisión, es necesario aplicar correcciones si se comparan resultados obtenidos en diferentes latitudes o alturas.
7. Efecto del Empuje Atmosférico
El peso de una muestra medida en condiciones de presión atmosférica no será el mismo que si se mide al vacío. Este efecto, explicado por el principio de Arquímedes, implica que un objeto experimenta una pérdida de peso equivalente al peso del aire desplazado.
En mediciones de precisión extrema, se deben hacer correcciones considerando la temperatura, la presión y la humedad del ambiente. Sin embargo, en mediciones estándar de laboratorio, este ajuste no suele ser necesario.
Reglas para el Uso de la Balanza
Para asegurar la precisión y el correcto funcionamiento de la balanza analítica, se deben seguir ciertas normas:
- Ubicarla en un lugar adecuado, preferiblemente en una sala separada del laboratorio para protegerla de vapores y otros agentes externos. Debe colocarse sobre una base firme para minimizar vibraciones y alejada de ventanas, calefactores, corrientes de aire y luz solar directa.
- Asegurar que la balanza esté nivelada.
- Mantenerla tarada y libre de objetos innecesarios en el platillo.
- Antes de cada pesada, verificar el punto cero y tarar nuevamente la balanza si es necesario.
- Para obtener medidas precisas, realizar una primera aproximación con la media pesada y luego realizar la pesada completa para afinar los valores en miligramos.
- Evitar cargar la balanza con un peso excesivo cuando indica 0,0000 g, ya que esto puede afectar su mecanismo.
- Utilizar recipientes adecuados, como pesafiltros, vidrios de reloj, crisoles o pequeños matraces, para evitar el contacto directo de sustancias con los platillos.
- Si se pesan líquidos corrosivos o sólidos volátiles, se deben utilizar recipientes herméticamente cerrados.
- Los objetos a pesar deben tener la misma temperatura que la balanza.
- No sobrecargar la balanza en ningún caso.
- Mantener la balanza limpia, pero sin el uso de líquidos en los platillos.
Tipos de Errores en la Pesada
1. Errores Sistemáticos y Accidentales
Toda medición conlleva cierta imprecisión. Estos errores pueden clasificarse en:
- Errores sistemáticos: Se deben a defectos en el instrumento de medida o a un uso incorrecto. Se pueden detectar comparando los resultados con otros métodos o instrumentos.
- Errores accidentales: Son aleatorios y no pueden ser controlados. Se reducen repitiendo la medición varias veces y calculando la media aritmética de los valores obtenidos.
2. Error Absoluto y Relativo
La importancia de un error depende de la magnitud medida. Un error de 1 gramo en una muestra de unos pocos gramos es significativo, mientras que el mismo error en una carga de varias toneladas es insignificante.
- Error absoluto: Diferencia entre la medición obtenida y el valor real de la magnitud.
- Error relativo: Se calcula dividiendo el error absoluto por el valor real de la magnitud medida. Si se multiplica por 100, se obtiene el porcentaje de error.
Ejemplo: Si una pesa patrón de 10 gramos se mide en una balanza y arroja un valor de 9,9996 g:
- Error absoluto: 10 – 9,9996 = 0,0004 g
- Error relativo: 0,0004 / 10 = 0,00004 (o 4 × 10⁻⁵)
- Porcentaje de error: 0,00004 × 100 = 0,004%
Siguiendo estos principios, se mejora la precisión de las mediciones y se minimizan las variaciones en los resultados obtenidos.
Unidades de Masa
Concepto de Masa
Cuando se suspenden objetos idénticos en un dinamómetro, se puede observar que la aguja del resorte indica la fuerza ejercida por el peso del objeto. Si se colocan varias unidades en el plato-soporte, la intensidad de la fuerza medida será proporcional a la cantidad de objetos agregados. Esta fuerza está relacionada con la cantidad de materia contenida en el objeto.
La masa es la cantidad de materia presente en un cuerpo y permanece constante en cualquier circunstancia, a diferencia del peso, que varía según la altitud y la latitud del lugar donde se mida.
Medición de la Masa
La masa es una magnitud cuantificable, lo que permite comparar diferentes cuerpos y sumar sus valores. Se mide utilizando instrumentos como balanzas y básculas.
Unidad de Masa: Kilogramo (kg)
El kilogramo es la unidad estándar para medir la masa y se estableció en la Conferencia General de Pesos y Medidas de 1880 en París. Su referencia original fue un prototipo de platino-iridio.
Unidades de Peso
La unidad fundamental en el sistema métrico es el gramo, que equivale a la masa de un centímetro cúbico de agua destilada a 4 °C y bajo una presión de 760 mm de mercurio. Se toma esta temperatura porque en ella el agua alcanza su máxima densidad y la presión se considera como estándar a nivel del mar.
Sistema Métrico de Pesas
Las unidades de masa en el sistema métrico incluyen:
Múltiplos:
- Decagramo (dag) = 10 gramos
- Hectogramo (hg) = 100 gramos
- Kilogramo (kg) = 1,000 gramos
- Decatonelada (mag) = 10,000 gramos (10 kg)
- Quintal métrico (qm) = 100,000 gramos (100 kg)
- Tonelada métrica ™ = 1,000,000 gramos (1,000 kg)
Submúltiplos:
- Decigramo (dg) = 0.1 gramos
- Centigramo (cg) = 0.01 gramos
- Miligramo (mg) = 0.001 gramos
En el laboratorio, generalmente se utilizan valores desde el kilogramo hasta el miligramo, y existen instrumentos que permiten medir con precisión décimas y centésimas de miligramo. Para ello, se emplean balanzas de precisión, aunque en algunos casos también se utilizan básculas. Las pesas suelen ser de latón, algunas con núcleo de plomo para mayor estabilidad.
Masa Volumétrica
La masa volumétrica se refiere a la cantidad de masa contenida en una unidad de volumen de una sustancia y se expresa mediante la fórmula:
p = m/V
Unidad de Masa Volumétrica
La unidad estándar para expresar la masa volumétrica es el kilogramo por metro cúbico (kg/m³), definida como la cantidad de masa presente en un volumen de un metro cúbico.
Volumen Específico
El volumen específico se refiere al volumen ocupado por una unidad de masa de una sustancia y se calcula con la ecuación:
v = V/m
Su unidad de medida es el metro cúbico por kilogramo (m³/kg).
Densidad
La densidad de un material homogéneo es la relación entre su masa volumétrica y la masa volumétrica de una sustancia de referencia. Se expresa mediante la siguiente fórmula:
D = p / p’
Las sustancias de referencia más utilizadas son:
- Agua para sólidos y líquidos.
- Aire para gases.
La masa volumétrica del agua varía poco con la temperatura y la presión, y su valor de referencia es de 1,000 kg/m³. En el caso del aire, su valor de referencia es de 1.293 kg/m³.
La densidad siempre se expresa como un número decimal y, debido a que la masa volumétrica del agua es 1,000 kg/m³, su valor numérico coincide con la densidad de sustancias expresada en esta escala.
Medidas de Volumen
La unidad principal para medir capacidades es el litro, que equivale a un decímetro cúbico. El decímetro cúbico es un submúltiplo del metro cúbico, la unidad fundamental de volumen. Un metro cúbico se define como el volumen de un cubo cuyas aristas miden un metro.
Las unidades de capacidad aumentan y disminuyen en múltiplos de 10, mientras que las unidades de volumen varían en múltiplos de 1,000.
Múltiplos y Submúltiplos del Litro:
- Mirialitro (mal) = 10,000 litros
- Kilolitro (kl) = 1,000 litros
- Hectolitro (hl) = 100 litros
- Decalitro (dal) = 10 litros
- Decilitro (dl) = 0.1 litros
- Centilitro (cl) = 0.01 litros
- Mililitro (ml) = 0.001 litros
Múltiplos y Submúltiplos del Metro Cúbico:
- Miriámetro cúbico (mam³) = 1,000,000,000,000 m³
- Kilómetro cúbico (km³) = 1,000,000,000 m³
- Hectómetro cúbico (hm³) = 1,000,000 m³
- Decámetro cúbico (dam³) = 1,000 m³
- Decímetro cúbico (dm³) = 0.001 m³
- Centímetro cúbico (cm³) = 0.000001 m³
- Milímetro cúbico (mm³) = 0.000000001 m³
La medición de líquidos requiere precisión, por lo que es importante conocer los métodos adecuados para realizarla. Existen dos formas principales de medición:
- Por contenido: Se vierte el líquido en un recipiente graduado hasta alcanzar la cantidad deseada.
- Por vertido: Se mide el líquido mientras se vacía de un recipiente, observando la cantidad transferida en la escala del mismo.
Estos métodos pueden producir diferencias de volumen debido al líquido que queda adherido a las paredes del recipiente. La precisión del vertido depende de la velocidad y del diseño del contenedor. Para evitar confusiones, los recipientes llevan inscripciones que indican su uso: (E) para medición por contenido y (A) para medición por vertido.
Volumetría
Introducción al Análisis Volumétrico
El análisis volumétrico, también llamado titulometría, consiste en la determinación de la cantidad de una sustancia mediante la medición del volumen de una disolución de concentración conocida que reacciona con la sustancia problema. En algunos casos, en lugar del volumen, se mide la masa.
Para que este método sea efectivo, la reacción debe cumplir ciertos requisitos:
- Ser cuantitativa: Debe producirse completamente. Se considera aceptable cuando la constante de equilibrio es mayor a 10⁶.
- Ser estequiométrica: Debe existir una relación proporcional entre la cantidad de reactivo y la sustancia problema.
- Ser instantánea: Si la reacción es lenta, se dificulta la identificación del punto final, por lo que en ocasiones es necesario aplicar calor o utilizar catalizadores.
- Punto final perceptible: Se debe poder identificar claramente mediante indicadores químicos o instrumentos como conductímetros, potenciómetros o espectrofotómetros.
Análisis Volumétrico Ácido-Base
Dentro de las reacciones químicas, las interacciones entre ácidos y bases son particularmente relevantes debido a su aplicación en la determinación precisa de concentraciones en disoluciones. Estas reacciones, conocidas como ácido-base, generan una sal y agua como productos finales, en un proceso denominado neutralización:
Ácido + Base → Sal + Agua
Ejemplo:
HCl + NaOH → NaCl + H₂O
En este tipo de reacción, una cantidad específica de ácido neutraliza una cantidad determinada de base. La relación entre los reactivos se expresa mediante equivalentes químicos:
Número de equivalentes del ácido = Número de equivalentes de la base
Dado que:
- Número de equivalentes del ácido = Nácido × Vácido
- Número de equivalentes de la base = Nbase × Vbase
Entonces:
Nácido × Vácido = Nbase × Vbase
Donde:
- Nácido: Normalidad del ácido
- Vácido: Volumen del ácido
- Nbase: Normalidad de la base
- Vbase: Volumen de la base
Este principio se aplica en valoraciones o titulaciones para determinar con precisión la concentración de una disolución problema agregando un volumen medido de una solución de concentración conocida.
Acidimetría
Para conocer la concentración de un ácido en una disolución, se emplea una base de concentración conocida disuelta en agua. La neutralización del ácido con la base permite calcular su concentración a partir del volumen de base consumido en la reacción.
El punto final de la reacción se detecta mediante un cambio de color en un indicador. Este proceso se denomina acidimetría, una técnica dentro del análisis volumétrico que mide el volumen de reactivos consumidos para determinar la concentración de una sustancia.
Procedimiento:
- Se toma una muestra de 10 ml del ácido en estudio y se vierte en un vaso de precipitados de 200 ml.
- Se añade agua destilada y una o dos gotas de un indicador, como anaranjado de metilo, que adquiere color rojo en presencia de un ácido.
- Se llena una bureta con una disolución valorada de hidróxido de sodio.
- Se añade gradualmente la base desde la bureta, observando el cambio de color del indicador, de rojo a amarillo, lo que indica la neutralización del ácido.
Alcalimetría
Cuando se determina la concentración de una base mediante una disolución de un ácido con concentración conocida, el proceso se denomina alcalimetría. Se realiza de forma similar a la acidimetría, pero en este caso el reactivo en estudio es una base.
Procedimiento:
- Se mide un volumen de 10 ml de hidróxido de sodio con una pipeta y se deposita en un vaso de precipitados.
- Se añaden una o dos gotas de un indicador, como fenolftaleína, que adquiere color rojo en presencia de una base.
- Se llena una bureta con una disolución ácida de concentración conocida.
- Se añade el ácido gota a gota hasta que la fenolftaleína se vuelve incolora, señalando la neutralización de la base.
El volumen de reactivo utilizado se determina midiendo la diferencia en los niveles de la bureta antes y después del proceso.
Uso de Soluciones Valoradas
Las soluciones valoradas se emplean en estos procedimientos, basándose en la neutralización entre cantidades equivalentes de ácido y base. La reacción de neutralización ocurre entre los iones oxonio (H₃O⁺) y los iones hidróxido (OH⁻), según la ecuación:
H₃O⁺ + OH⁻ → 2H₂O
Dado que un equivalente-gramo de ion oxonio neutraliza un equivalente-gramo de ion hidróxido, la neutralización ocurre en proporciones equivalentes entre ambos iones, permitiendo la determinación precisa de concentraciones en disoluciones ácidas o básicas.
Conceptos Fundamentales de Normalidad y Valoración
La normalidad de una disolución se define como el número de equivalentes-gramo presentes por litro de disolución. Un equivalente-gramo de una sustancia es la cantidad en gramos que puede reemplazar, reaccionar o ceder un ion gramo de hidrógeno. Una disolución normal contiene un equivalente-gramo por litro; una decimonormal contiene 1/10 de equivalente-gramo por litro, y así sucesivamente.
En una reacción de neutralización, se utilizan ciertos volúmenes de una disolución valorada con una base de normalidad conocida para neutralizar un ácido de normalidad desconocida. La relación entre ambos sigue la ecuación:
También se expresa en términos de protones cedidos y captados:
Donde:
- representa la molaridad,
- el volumen de la disolución,
- el número de protones cedidos o captados.
Valoraciones Ácido-Base
En la valoración de un ácido fuerte con una base fuerte, se emplea fenolftaleína o heliantina como indicador, debido a la variación de pH que ocurre en el punto de equivalencia. Cuando se añade hidróxido de sodio a ácido clorhídrico, el pH aumenta hasta alcanzar la neutralización en pH 7. Si en lugar de ácido clorhídrico se usa ácido acético, la zona de viraje es más estrecha, pero aún puede emplearse fenolftaleína. Para valorar una disolución de amoníaco con ácido clorhídrico, se recomienda el rojo de metilo como indicador, debido a su rango de viraje entre pH 4 y 6.
Análisis Volumétrico Redox
En estos análisis, la sustancia analizada y el reactivo valorante experimentan una reacción de reducción-oxidación, lo que genera una variación del potencial redox en el punto de equivalencia. El equivalente-gramo de oxidación de una sustancia es la cantidad en gramos capaz de captar un mol de electrones, mientras que el equivalente-gramo de reducción es la cantidad en gramos capaz de ceder un mol de electrones.
Por ejemplo, en la reducción del permanganato en medio ácido:
La masa equivalente-gramo del permanganato de potasio se obtiene dividiendo su masa molecular entre el número de electrones intercambiados:
En el punto de equivalencia de una valoración redox, se cumple la ecuación:
Para detectar el punto final, se puede medir el potencial con un electrodo o usar indicadores redox, los cuales cambian de color dependiendo del potencial de la disolución. Si el potencial de cambio de color del indicador coincide con el del punto de equivalencia, se podrá detectar visualmente el final de la reacción.
Indicadores Redox
Estos compuestos tienen la capacidad de cambiar de color cuando el potencial de la disolución sufre una variación brusca cerca del punto de equivalencia. Este cambio de color es lo que permite identificar el final de una valoración. Existen diversas sustancias utilizadas como indicadores redox, entre las más comunes están:
- Difenilamina: En presencia de un fuerte agente oxidante, pierde dos electrones y dos protones, transformándose en difenilbenzidina, que es incolora. Su cambio de color es de incoloro a violeta. Como la difenilamina es poco soluble en agua, se pueden añadir grupos sulfónicos para mejorar su solubilidad.
- 2,6-diclorindofenol: No tiene color en su forma reducida y se vuelve azul al oxidarse. Es ampliamente utilizado en farmacia, especialmente en la determinación de vitamina C.
- Permanganato: Funciona como autoindicador, ya que su forma oxidada es violeta y la reducida es incolora. Su potencial redox es alto, por lo que es necesario realizar varias valoraciones para alcanzar el punto de equivalencia.
Método del Punto Claro
Este procedimiento se usa en la valoración de yodo. Se añade nitrato de plata () a una solución que contiene yoduro ():
- Antes del punto de equivalencia: La plata se rodea de iones formando micelas con carga negativa, lo que genera una solución turbia.
- En el punto de equivalencia: Las micelas se neutralizan y se produce una floculación instantánea, clarificando la solución.
Método de Mohr
Se emplea para valorar haluros, específicamente cloruros (), con la siguiente reacción:
El punto final se identifica por la aparición de un precipitado rojizo de cromato de plata (). Sin embargo, debido al precipitado blanco del cloruro de plata, el color observado es un tono rosa tenue.
Este método es uno de los más antiguos y eficaces para la valoración de cloruros en agua, aunque presenta ciertos inconvenientes. Por ejemplo, si la cantidad de cromato utilizada no es la adecuada, el precipitado rojo no se forma en el punto exacto de equivalencia. Además, el pH de la disolución debe mantenerse entre 6 y 10 para evitar errores en la valoración.
Método de Volhard
Este procedimiento no utiliza una valoración directa con , sino que implica añadir un exceso conocido de este reactivo a la disolución que contiene los iones cloruro. Posteriormente, el exceso de plata se valora con una disolución de tiocianato.
El punto final de la valoración se detecta mediante un indicador férrico, formando un complejo coloreado soluble. A diferencia del método de Mohr, aquí el punto final no se indica por la formación de un precipitado, sino por la aparición del complejo. Para que la valoración sea precisa, el pH de la disolución debe ser fuertemente ácido.
Indicadores de Adsorción
Estos indicadores son sustancias orgánicas de naturaleza ácida o básica que tienen la capacidad de adsorberse en la superficie de los precipitados de haluros de plata. Cuando esto ocurre, el color del indicador cambia debido a una modificación en la energía de resonancia de sus electrones.
En disolución, el indicador está disociado y sus iones están rodeados por moléculas de agua. Sin embargo, cuando el ion se adsorbe en la superficie del precipitado, la interacción cambia y esto se traduce en un cambio de color.
Estos indicadores se emplean principalmente en la valoración de iones haluros. Un ejemplo común es la fluoresceína, un indicador fluorescente ampliamente utilizado en estas técnicas.
Análisis Volumétrico: Complexometría
En este tipo de análisis volumétrico se forman compuestos poco disociados, que pueden ser solubles o insolubles. Hasta hace poco, su uso era limitado debido a la falta de indicadores adecuados y a que, en muchas ocasiones, la relación estequiométrica no estaba bien definida.
El reactivo utilizado en la valoración se une al analito formando un complejo estable. En el punto de equivalencia, toda la sustancia analizada estará completamente complejada.
El punto final de la valoración se puede detectar mediante indicadores específicos.
Uno de los reactivos más empleados en este tipo de análisis es el ácido etilendiaminotetraacético (EDTA), debido a su capacidad para formar complejos estables con diversos iones metálicos.
Disoluciones y Diluciones
Principios Generales de las Soluciones
Las disoluciones están formadas por dos componentes: el disolvente, que se encuentra en mayor proporción, y el soluto, que está presente en menor cantidad. Sin embargo, en algunos casos no es fácil distinguir cuál es el disolvente y cuál el soluto.
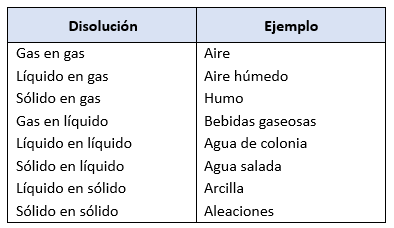
En general, cuando se habla de disoluciones se hace referencia a la disolución de un sólido en un líquido (frecuentemente en agua), pero también existen otros tipos, ya que tanto el soluto como el disolvente pueden ser sólidos, líquidos o gases.
La mayoría de las reacciones químicas ocurren en disolución, por lo que disolver una sustancia es un paso fundamental en el análisis químico y en la determinación de sus propiedades.
Las disoluciones se clasifican en:
- Diluidas: Contienen una pequeña cantidad de soluto.
- Concentradas: Tienen una proporción considerable de soluto.
- Saturadas: No admiten más cantidad de soluto en las condiciones dadas.
En el caso de disoluciones acuosas, muchos solutos se ionizan, permitiendo la conducción de electricidad, lo que las convierte en disoluciones electrolíticas.
Los disolventes más utilizados en química incluyen:
- Agua y agua destilada.
- Ácidos y bases inorgánicas.
- Disolventes orgánicos como bencina, alcohol, acetona y éter.
Naturaleza, Tipo y Propiedades de las Disoluciones
Las partículas de la fase dispersa en una disolución son extremadamente pequeñas, con un tamaño menor a . Estas partículas son invisibles incluso con ultramicroscopios, no sedimentan y pueden atravesar filtros de papel y membranas de pergamino.
En términos generales, los sistemas materiales heterogéneos se pueden clasificar según el estado físico de sus fases dispersas:
- Suspensiones: Se forman cuando la fase dispersa es un sólido y el medio de dispersión es un líquido.
- Ejemplo: Agua con partículas de carbón en suspensión.
- Emulsiones: Se producen cuando tanto la fase dispersa como el medio dispersante son líquidos.
- Ejemplo: Mezclas de aceite en agua o goma arábiga en agua.
Importancia y Aplicaciones de las Disoluciones
El uso de disoluciones es fundamental en diversas áreas de la química y la industria. Algunas de sus aplicaciones más relevantes incluyen:
- Conservación de productos: Muchas sustancias se almacenan en disolventes para evitar reacciones indeseadas.
- Ejemplo: El sodio se mantiene sumergido en benceno para evitar su contacto con el aire y prevenir su oxidación.
- Extracción de compuestos: Se emplean disolventes como el agua, el benceno, el éter y el alcohol para separar componentes específicos de una mezcla.
- Reacciones químicas: La mayoría de las reacciones químicas, especialmente las que ocurren en laboratorios e industrias, se llevan a cabo en disolución, siendo el agua el disolvente más común.
Propiedades del Agua como Medio de Reacción
Para que dos o más sustancias reaccionen, no siempre es suficiente con ponerlas en contacto. En muchos casos, es necesario modificar las condiciones de la mezcla, como aplicar calor, presión o disolverlas en un líquido.
Por ejemplo, el sulfato de cobre y el hidróxido de sodio no reaccionan cuando están en estado sólido, pero al disolverse en agua y mezclarse, ocurre una reacción que forma hidróxido de cobre.
Cuando una reacción se lleva a cabo en agua, se dice que ocurre en medio acuoso. Muchas de las reacciones realizadas en laboratorios e industrias tienen lugar en este entorno, ya que al disolverse en agua, los reactivos reaccionan con mayor rapidez.
Las razones por las cuales el agua es un medio adecuado para las reacciones químicas incluyen:
- Gran capacidad de disolución: Disuelve fácilmente compuestos iónicos como sales y también algunos compuestos no iónicos como azúcares y alcoholes, algo que no ocurre con otros disolventes como el aguarrás o el benceno.
- Alto calor específico: Puede absorber grandes cantidades de calor sin que su temperatura aumente significativamente, lo que la hace útil en reacciones exotérmicas.
- Económica y accesible: Su bajo costo la convierte en un medio ideal para reacciones a escala industrial.
Propiedades de las Disoluciones: Punto de Fusión y Ebullición
Cuando un soluto se disuelve en un disolvente, altera algunas de sus propiedades. Por ejemplo, el agua con sal hierve a temperaturas más altas y se congela a temperaturas más bajas que el agua pura. Este fenómeno ocurre también con otros disolventes y solutos.
Las disoluciones tienen:
- Puntos de ebullición más altos que el disolvente puro.
- Puntos de fusión más bajos que el disolvente sin soluto.
Estos cambios dependen de la cantidad de soluto presente, sin importar su naturaleza química.
Ósmosis y Presión Osmótica
En algunos casos, es posible separar el soluto del disolvente utilizando una membrana semipermeable, como la descubierta por Pfeffer en 1877. Estas membranas permiten el paso del disolvente, pero bloquean el soluto.
Si se colocan dos disoluciones de diferente concentración separadas por una membrana semipermeable, el disolvente se moverá de la disolución más diluida hacia la más concentrada. Este proceso se llama ósmosis.
El flujo de disolvente continúa hasta que la presión ejercida por ambas disoluciones sobre la membrana se equilibra. La presión osmótica es la presión necesaria para detener este flujo.
La presión osmótica depende de la concentración de la disolución:
- Cuanto mayor sea la cantidad de soluto en un volumen dado de disolvente, mayor será la presión osmótica.
Si se coloca una disolución junto con su disolvente en un recipiente con una membrana semipermeable, se observará que el nivel del disolvente disminuirá, mientras que el nivel de la disolución aumentará debido al paso del disolvente a través de la membrana.
Ecuación de Van’t Hoff para la Presión Osmótica
En 1885, Van’t Hoff estudió la presión osmótica y encontró que en disoluciones diluidas sigue la misma ecuación de los gases ideales:
π · V= nRT
Donde:
- π: Presión osmótica.
- V: Volumen de la disolución.
- n: Número de moles de soluto.
- R: Constante de los gases ( atm·L/mol·K).
- T: Temperatura en Kelvin.
Dado que la concentración molar se define como:
C = n/V
La ecuación se puede escribir como: π = cRT
Esta ecuación permite calcular la masa molecular del soluto a partir de su presión osmótica.
n = a/M
Donde a es la cantidad de soluto en gramos y M su masa molecular.
M = aRT/πV
Explicación Molecular de la Ósmosis
Desde la perspectiva de la teoría cinético-molecular, tanto el soluto como el disolvente están en movimiento continuo dentro de la disolución.
- En la cara de la membrana que está en contacto con el disolvente puro, las moléculas chocan con la superficie y atraviesan la membrana.
- En la otra cara, donde hay soluto, algunas moléculas del disolvente intentan atravesar la membrana, pero la presencia del soluto reduce la cantidad de moléculas que pueden pasar en esa dirección.
- Como resultado, hay un flujo neto de disolvente hacia la disolución, lo que provoca un aumento del nivel de la disolución y una disminución del nivel del disolvente.
Este fenómeno tiene aplicaciones en procesos biológicos, en la industria farmacéutica y en el tratamiento de aguas, entre otros.
Disoluciones Electrolíticas
Las disoluciones de ácidos, bases y sales tienen una característica especial: conducen electricidad, a diferencia de otras soluciones químicas.
Para comprender este fenómeno, observemos lo siguiente:
- El agua pura no conduce electricidad. Si se sumergen dos electrodos conectados a una fuente de energía en agua destilada, no habrá paso de corriente.
- Sin embargo, si se añade un ácido, base o sal al agua, la corriente eléctrica comienza a fluir.
Este comportamiento fue explicado por Arrhenius en 1877. Propuso que, al disolverse en agua, los ácidos, bases y sales se separan en partículas cargadas llamadas iones.
- Los iones positivos (cationes) se mueven hacia el electrodo negativo (cátodo).
- Los iones negativos (aniones) se dirigen al electrodo positivo (ánodo).
A diferencia de los metales, donde la electricidad fluye a través del movimiento de electrones, en un electrolito la corriente se transporta gracias al desplazamiento de iones.
Ejemplo: Disolución de Cloruro Cúprico (CuCl₂)
Si disolvemos cloruro cúprico en agua, la sal se separa en:
La solución sigue siendo eléctricamente neutra, ya que el número de cargas positivas y negativas sigue siendo igual.
Si sumergimos dos electrodos conectados a una fuente de energía en la solución, los iones Cl⁻ se dirigirán al ánodo y los iones Cu²⁺ irán al cátodo.
Reacciones en los electrodos:
- En el cátodo (electrodo negativo):
- Los iones Cu²⁺ llegan al cátodo y captan electrones.
- Se convierten en átomos de cobre metálico, que se depositan sobre el electrodo.
- En el ánodo (electrodo positivo):
- Los iones Cl⁻ ceden electrones y se transforman en gas cloro, que se libera en forma de burbujas.
Así se completa el circuito eléctrico: en el electrolito, la corriente se transporta por el movimiento de iones; en los electrodos, por el flujo de electrones.
Preparación de Disoluciones
Las soluciones verdaderas son mezclas homogéneas en las que el tamaño de las partículas dispersas es menor a 10⁻³ µm. Esto implica que:
- No pueden observarse con microscopios ópticos.
- No pueden separarse por filtración.
- No sedimentan.
Una disolución está compuesta por:
- Soluto: la sustancia disuelta, presente en menor cantidad.
- Disolvente: el componente en mayor proporción.
Dependiendo del número de componentes, las disoluciones pueden ser:
- Binarias: formadas por un soluto y un disolvente.
- Ternarias: contienen dos solutos y un disolvente.
- Cuaternarias: contienen tres solutos y un disolvente.
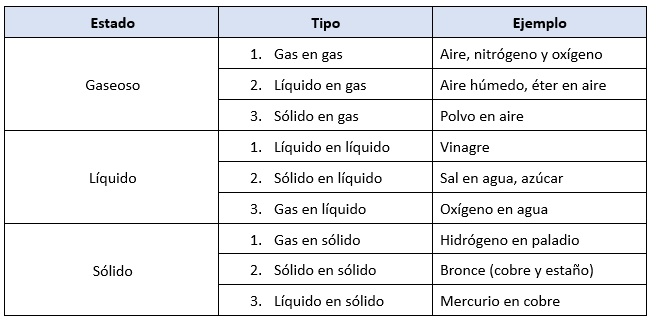
Tipos de Disoluciones
Según el estado físico de sus componentes, pueden clasificarse en:
- Sólidas:
- Aleaciones metálicas (ejemplo: bronce, que es cobre y estaño).
- Minerales con impurezas dispersas.
- Líquidas:
- Agua con sal o azúcar.
- Alcohol en agua.
- Gaseosas:
- Aire (mezcla de oxígeno, nitrógeno y otros gases).
- Gases disueltos en líquidos, como el dióxido de carbono en refrescos.
Las disoluciones acuosas, donde el disolvente es agua, son las más utilizadas en química debido a sus propiedades de solubilidad.
Preparación de Soluciones Patrón
Las soluciones patrón son aquellas cuya concentración es conocida con gran precisión. Se emplean para determinar la concentración de otras disoluciones mediante comparaciones en análisis químicos. La exactitud en su preparación es fundamental, ya que cualquier error afectará la precisión de los resultados obtenidos en titulaciones.
Según la Asociación Española de Normalización y Certificación (AENOR), una solución patrón es un sistema de referencia que permite establecer y conservar valores de una magnitud, sirviendo como base para la medición de otras sustancias.
Proceso de Preparación de Soluciones Patrón
- Cálculo de los valores necesarios
- Se determina la cantidad exacta de soluto y el volumen de disolvente requerido.
- Pesado del soluto
- Se mide la cantidad de soluto con precisión para evitar errores en la concentración.
- Disolución del soluto
- Se introduce el soluto en un matraz aforado con ayuda de un embudo.
- Adición inicial de disolvente
- Se añade una cantidad suficiente de disolvente para disolver completamente el soluto.
- Ajuste del volumen final
- Se completa con más disolvente hasta alcanzar un nivel cercano a la marca de aforo.
- Enrase final
- Se usa una pipeta o cuentagotas para ajustar exactamente el volumen hasta la marca del matraz.
- Si por error se sobrepasa el aforo, se mide el exceso y se corrige el volumen en los cálculos.
Tipos de Patrones en Química
Existen sustancias de alta pureza llamadas patrones primarios, que sirven para valorar con exactitud otras soluciones, conocidas como patrones secundarios o soluciones valoradas.
Sustancias Químicas como Patrones Primarios
Para que una sustancia pueda emplearse como patrón primario, debe cumplir ciertos requisitos:
- Alta pureza química
- Mínimo 99,8% de pureza.
- Si tiene impurezas, deben ser inertes y conocidas.
- Estabilidad durante la pesada
- No debe reaccionar con el oxígeno, la humedad o agentes externos.
- No debe ser higroscópica (que absorba agua del ambiente).
- No debe ser eflorescente (que pierda agua de hidratación espontáneamente).
- Solubilidad adecuada
- Debe disolverse completamente en el disolvente en las condiciones de uso.
- Peso equivalente alto
- Se prefiere que tenga un peso equivalente elevado para reducir errores en la pesada.
Ejemplos de Patrones Primarios
- Ácido benzoico
- Óxido de arsénico (III)
- Nitrato de plata
- Biftalato de potasio
- Bromato de potasio
- Dicromato de potasio
- Carbonato de sodio
- Cloruro de sodio
- Oxalato de sodio
- Yodato de potasio
- Óxido de zinc
- Tris (hidroximetil) aminometano
Ejemplos de Patrones Secundarios
- Ácido clorhídrico (HCl)
- Hidróxido de sodio (NaOH)
Estos patrones secundarios se emplean en valoraciones ácido-base, pero requieren una previa estandarización con patrones primarios para asegurar su precisión.
Disoluciones Valoradas
En los análisis volumétricos, se determina el volumen de una disolución con una concentración conocida, denominada disolución valorante, que se necesita para reaccionar completamente con el analito. A partir de este volumen, se calcula la concentración del analito en la muestra.
Una disolución valorante es un reactivo cuya concentración se conoce con precisión y se utiliza en análisis volumétricos. La valoración se realiza añadiendo esta disolución lentamente a la muestra, usando una bureta o un dispositivo de medición de volumen, hasta que la reacción sea completa. El volumen consumido se obtiene por diferencia entre las lecturas inicial y final de la bureta.
Requisitos de las Disoluciones Valorantes
Las disoluciones valorantes deben cumplir con las siguientes condiciones:
- Estabilidad: Deben ser suficientemente estables para que su concentración solo necesite ser determinada una vez.
- Reacción rápida: Deben reaccionar con el analito sin demora para evitar errores.
- Reacción completa: Deben reaccionar completamente con el analito para definir con precisión el punto final.
- Selectividad: Deben reaccionar específicamente con el analito, evitando interferencias.
El punto de equivalencia se alcanza cuando la cantidad de disolución valorante agregada es equivalente a la cantidad de analito presente en la muestra.
En algunas ocasiones, se añade un exceso de disolución valorante y posteriormente se mide el exceso con otra valoración, lo que se conoce como valoración por retroceso.
Diferencia entre Punto de Equivalencia y Punto Final
El punto de equivalencia es un valor teórico que no puede medirse directamente. Se estima mediante un punto final, que es un cambio físico observable en la disolución, como:
- Cambio de color o aparición/desaparición de turbidez.
- Uso de indicadores que reaccionan con el analito.
- Medición con instrumentos como voltímetros, amperímetros, conductímetros o colorímetros.
Preparación de Disoluciones Valoradas
Las disoluciones valoradas pueden prepararse a partir de sólidos o líquidos.
a) Preparación a partir de un sólido
- Si el sólido es un patrón primario, se pesa con precisión en la balanza analítica, se disuelve en un disolvente adecuado y se transfiere a un matraz aforado, completando con agua destilada hasta la marca de aforo.
- Si el sólido no es un patrón primario, la pesada puede ser menos exacta y se debe valorar posteriormente con un patrón primario.
b) Preparación a partir de un líquido
- Si el líquido es una solución de concentración conocida, se mide con una pipeta aforada y se transfiere a un matraz aforado, completando con agua destilada hasta el enrase.
- Si el líquido no es una solución patrón, se mide con una probeta y se diluye en un matraz aforado hasta la marca de aforo.
Conservación de las Disoluciones
Las disoluciones deben almacenarse de acuerdo con su naturaleza:
- Almacenamiento general: Se guardan en frascos de vidrio etiquetados y protegidos.
- Refrigeración: Algunas deben mantenerse entre 1 y 4°C o en congelación.
- Esterilización: Se aplica en soluciones utilizadas en análisis microbiológicos.
- Termorresistentes: Soportan la esterilización por calor.
- Termolábiles: Pierden sus propiedades con el calor.
- Protección contra la luz: Algunas sustancias fotosensibles, como el bromuro de bario, deben almacenarse en frascos oscuros.
Resumen
Las disoluciones valoradas son esenciales en análisis químicos, permitiendo determinar la concentración de un analito. Su preparación debe ser precisa, asegurando estabilidad, selectividad y reactividad. Su conservación adecuada es clave para mantener su exactitud y funcionalidad.
Definiciones
Sistemas Materiales Homogéneos y Heterogéneos
Un sistema material puede estar compuesto por una o varias sustancias. Dependiendo de su uniformidad, los sistemas materiales se dividen en dos categorías:
- Sistemas Materiales Homogéneos: Presentan una composición uniforme en toda su extensión, lo que significa que sus propiedades son idénticas en cualquier muestra tomada del sistema.
- Sistemas Materiales Heterogéneos: Poseen una composición variable, lo que provoca diferencias en sus propiedades en distintas partes del sistema. A estos sistemas también se les conoce como mezclas heterogéneas o simplemente mezclas.

Separación de los Componentes de una Mezcla Heterogénea
Las mezclas heterogéneas están compuestas por sustancias con diferentes propiedades y composición. Para separar sus componentes, se utilizan distintos métodos según sus características físicas.
Separación según la Diferencia de Densidad
- Sedimentación: Permite la separación de los componentes de una mezcla debido a la acción de la gravedad. El componente más denso se deposita en el fondo, permitiendo su posterior separación mediante decantación.
- Ejemplo: Mezcla de agua y aceite, que se separa utilizando un embudo de decantación.
- Centrifugación: Aumenta artificialmente la diferencia de peso entre los componentes de la mezcla mediante la rotación a alta velocidad, facilitando su separación.
Separación de un Sólido y un Líquido
- Filtración: Se utiliza para separar mezclas donde un sólido en partículas finas se encuentra suspendido en un líquido. Se emplea un material poroso, como un filtro, para retener el sólido mientras el líquido atraviesa el material filtrante.
Separación de Mezclas de Sólidos
- Tamizado: Método basado en la diferencia de tamaño de las partículas de los componentes sólidos. Se hace pasar la mezcla por un tamiz con poros de un tamaño específico, permitiendo el paso de las partículas más pequeñas mientras se retienen las más grandes.
- Atracción Magnética: Se emplea cuando una de las sustancias es ferromagnética (como el hierro o el níquel) y puede ser separada utilizando un imán.
Sistemas Materiales Homogéneos: Disoluciones y Sustancias Puras
Cuando un sistema homogéneo está compuesto por dos o más sustancias combinadas de manera uniforme, se denomina disolución. Si se divide en muestras más pequeñas, todas tendrán la misma proporción de componentes y mantendrán las mismas propiedades.
- Disolvente: Componente que se encuentra en mayor proporción dentro de la disolución.
- Soluto: Sustancia presente en menor cantidad en la disolución.
Tanto el disolvente como el soluto pueden presentarse en estado sólido, líquido o gaseoso.
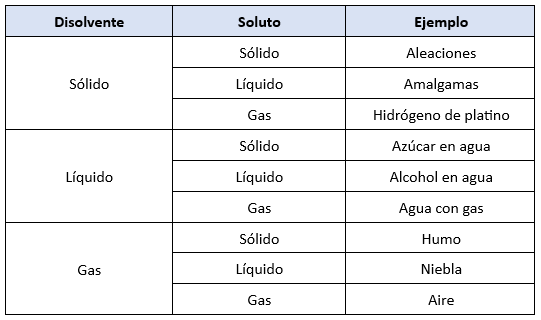
Un sistema material homogéneo constituido por un solo componente se denomina sustancia pura: pueden ser sólidos, líquidos o gases.
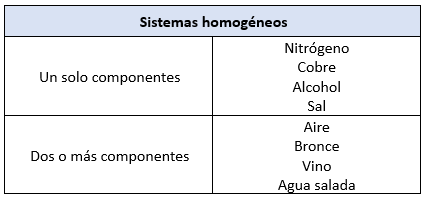
Disoluciones
Cuando la cantidad de soluto es baja, el proceso de disolución ocurre de manera rápida y sencilla, dando lugar a una disolución diluida.
Si se continúa agregando soluto, la concentración de la disolución aumenta, por lo que se denomina disolución concentrada a aquella que contiene una cantidad elevada de soluto disuelto.
Cuando la disolución alcanza un punto en el que no puede disolver más soluto, se considera saturada.
Separación de los componentes de una disolución
A) Separación de sólidos disueltos en líquidos
Para extraer sólidos disueltos en líquidos, se emplea la evaporación, que puede realizarse de manera natural a temperatura ambiente o de forma acelerada aplicando calor.
B) Separación de líquidos mezclados entre sí
Cuando se necesita separar líquidos que se han disuelto entre sí y poseen distintos puntos de ebullición, se emplea la destilación. Si las temperaturas de ebullición son muy similares, la separación no será completamente eficaz con un solo proceso, por lo que se utilizan destilaciones repetidas.
C) Separación de una mezcla de gases
Un ejemplo común es la separación de los componentes del aire, que se lleva a cabo en dos etapas:
- Licuación: Se somete el aire a alta presión y luego se le permite expandirse de manera brusca, provocando su licuación.
- Destilación: Se aumenta gradualmente la temperatura, permitiendo la evaporación primero del nitrógeno y posteriormente del oxígeno. Este proceso, llamado destilación fraccionada, permite obtener estos gases por separado.
Concentración de una disolución
Clasificar las disoluciones como diluidas, concentradas o saturadas no proporciona datos precisos sobre la cantidad exacta de soluto en relación con el disolvente. Para cuantificar esta proporción, se utiliza el concepto de concentración.
La concentración de una disolución es un valor numérico que indica la proporción de soluto presente en una cantidad determinada de disolución. Se puede expresar de varias formas:
a) Gramos por litro de disolución
Indica la cantidad de gramos de soluto disueltos en un litro de disolución:
b) Porcentaje en peso
Representa la cantidad de soluto en gramos contenida en cada 100 gramos de disolución:
Sin embargo, este porcentaje no indica la relación en volumen entre soluto y disolvente. Para conocer esta relación, es necesario contar con el dato de densidad de la disolución.
Solubilidad
La solubilidad indica la cantidad máxima de soluto que puede disolverse en un litro de agua antes de que la disolución se sature. Se representa con la letra S y se mide en moles por litro.
En la mayoría de los casos, un incremento en la temperatura favorece la solubilidad, es decir, permite disolver una mayor cantidad de soluto en el disolvente.
La solubilidad es una propiedad específica de cada par soluto-disolvente y debe especificarse junto con la temperatura y la cantidad de disolvente para ser correctamente definida.
Se puede concluir que la solubilidad de un soluto en un disolvente equivale a la concentración que alcanza una disolución saturada en determinadas condiciones.
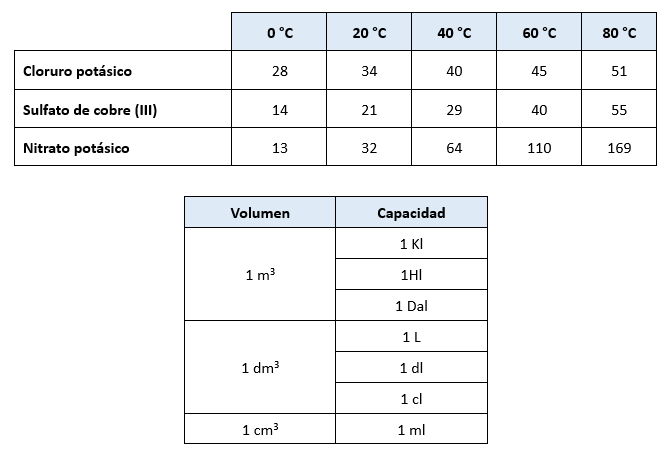
Sustancias puras
En los sistemas homogéneos no es posible distinguir a simple vista si están formados por uno o varios componentes. Sin embargo, cuando un sistema homogéneo mantiene sus propiedades constantes en cualquier parte y estas no varían al experimentar cambios de estado, se considera una sustancia pura.
Propiedades características de las sustancias puras
- Densidad: Es una propiedad de la materia, aunque por sí sola no permite determinar si una sustancia es pura o no.
- Temperatura de ebullición: Es un rasgo distintivo de las sustancias puras, ya que cada una tiene un punto de ebullición específico.
Tipos de sustancias puras: elementos y compuestos
- Compuestos: Son sustancias puras que pueden descomponerse en otras más simples mediante reacciones químicas.
- Elementos: Son sustancias puras que no pueden descomponerse en otras más simples.
Separación de los componentes de un compuesto
Para descomponer un compuesto en sus elementos, se emplean dos métodos principales:
- Descomposición térmica: Muchos compuestos pueden romperse en sustancias más simples al aplicar calor.
- Electrólisis: Consiste en la descomposición de un compuesto utilizando corriente eléctrica cuando está disuelto o en estado fundido.
La electrólisis es el proceso en el que una sustancia se descompone por acción de una corriente eléctrica continua.
Es importante distinguir que un compuesto no es lo mismo que una mezcla.
- En una mezcla, los componentes pueden combinarse en cualquier proporción y mantienen sus propiedades individuales.
- En un compuesto, los elementos se combinan en proporciones fijas y la sustancia resultante tiene propiedades distintas a las de sus componentes originales.
Los compuestos son sustancias puras que pueden descomponerse en sustancias más simples mediante calor o electricidad.
Por otro lado, las sustancias que no pueden dividirse en partes más simples reciben el nombre de elementos.
Formas de calcular y expresar la concentración de las disoluciones
La cantidad de soluto presente en un disolvente se expresa a través de distintas unidades de concentración, entre las que se incluyen:
- Porcentajes (%):
- En peso.
- En volumen.
- En peso/volumen.
- Partes por millón (ppm).
- Otras unidades de concentración:
- Molaridad.
- Molalidad.
- Normalidad.
Porcentajes o tanto por ciento
Porcentaje en peso
Este valor indica la cantidad de gramos de soluto presentes en 100 gramos de disolución. Se calcula con la siguiente fórmula:

Dado que la masa total de la disolución es la suma de la masa del soluto y del disolvente, podemos aplicar este cálculo a un ejemplo:
Ejemplo:
Si una disolución contiene 25 gramos de NaOH en 80 gramos de agua, primero sumamos las masas para obtener la masa total de la disolución:
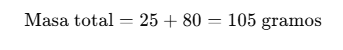
Luego, aplicamos la fórmula para determinar el porcentaje en peso.
Porcentaje en volumen
Expresa los mililitros de soluto que hay en 100 ml de disolución, y se calcula de la siguiente manera:

Ejemplo:
Si una disolución se prepara con 12 ml de HCl en 38 ml de agua, la masa total de la disolución será:
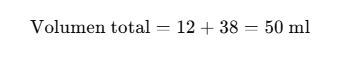
Aplicamos la fórmula para hallar el porcentaje en volumen.
Porcentaje peso/volumen
Este valor indica cuántos gramos de soluto hay en 100 ml de disolución y se calcula con la siguiente expresión:

Ejemplo:
Si disolvemos 3 gramos de NaCl en agua hasta alcanzar un volumen de 35 ml, aplicamos la fórmula para calcular el porcentaje peso/volumen.
% peso / volumen = 3/35 x 100
Partes por millón (ppm)
Las partes por millón (ppm) expresan la cantidad de gramos de soluto por cada 1.000.000 de gramos de disolución. En disoluciones acuosas, esta unidad equivale a miligramos de soluto por litro de disolución.
Ejemplo:
Si tenemos una disolución de NaCl al 9%, significa que hay 9 gramos de NaCl en 100 gramos de disolución. Para convertir esto a partes por millón, aplicamos la regla de tres:
9 ——————— 100
X —————- 1.000.000
Resolviendo para , obtenemos 90.000 ppm.
Molaridad
La molaridad (M) indica el número de moles de soluto disueltos en un litro de disolución. Se expresa con la siguiente fórmula:

Para calcular el número de moles de un soluto, se utiliza la relación:
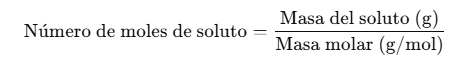
Ejemplo:
¿Cuántos moles de HCl hay en 1,5 litros de una solución 2 M?
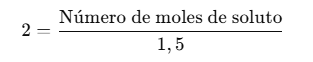
Multiplicando:
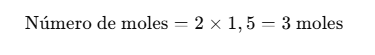
Molalidad
La molalidad (m) representa el número de moles de soluto disueltos en un kilogramo de disolvente. Se calcula con la fórmula:

Ejemplo:
Calcular la molalidad de una disolución que contiene 40 gramos de NaOH en 500 gramos de agua.
- Masa molar de NaOH = 40 g/mol
- Número de moles de NaOH:
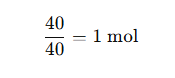
- Masa del disolvente en kg:
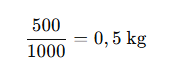
- Molalidad:
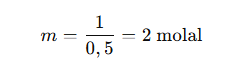
Normalidad
Antes de definir la normalidad, es necesario comprender el concepto de equivalente químico o peso-equivalente.
El peso-equivalente de un compuesto es la cantidad de dicho compuesto que reacciona con 8 partes de oxígeno o que reemplaza una cantidad específica de iones en una reacción química.
Cálculo del peso-equivalente
- Reacciones redox: Se obtiene dividiendo la masa molar de la sustancia entre el número de electrones ganados o perdidos en la reacción.
- Reacciones ácido-base:
- Ácidos: Se calcula dividiendo la masa molar del ácido entre el número de hidrogeniones reemplazables.
- Bases: Se divide la masa molar de la base entre el número de grupos OH disponibles.
- Sales: Se obtiene dividiendo la masa molar de la sal entre la carga total de los aniones presentes en la molécula.
Ejemplo de cálculo del peso-equivalente
Para NaOH (hidróxido de sodio):
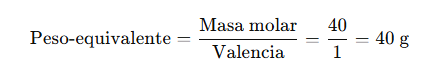
Cálculo de la normalidad
La normalidad (N) se define como el número de equivalentes-gramo de soluto presentes en un litro de disolución.

Ejemplo:
¿Cuál es la normalidad de una disolución con 5 gramos de NaOH en 200 ml (0,2 L) de disolución?
- Peso-equivalente de NaOH = 40 g
- Número de equivalentes-gramo:
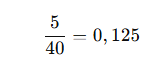
- Normalidad:
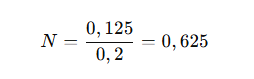
Diluciones
Las diluciones son procesos comunes en el laboratorio para ajustar la concentración de soluciones.
Cuando se realiza una dilución, se indica la proporción de la sustancia inicial y la cantidad final obtenida.
Por ejemplo, una dilución 1:4 significa que se toma 1 parte de muestra y se mezcla con 3 partes de disolvente, obteniendo un total de 4 partes de disolución.
La concentración final de una disolución diluida se calcula con la fórmula:
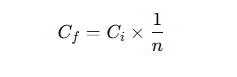
Donde:
- Ci = concentración inicial
- Cf = concentración final
- n = factor de dilución
Si se conoce la concentración y volumen iniciales, así como el volumen final, se aplica la siguiente ecuación:
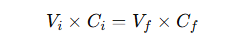
Donde:
- Vi = volumen inicial
- Ci = concentración inicial
- Vf = volumen final
- Cf = concentración final
Ejemplo:
Se desea preparar 10 ml de una disolución de HCl 0,1 M a partir de HCl 1M.
Aplicamos la fórmula:
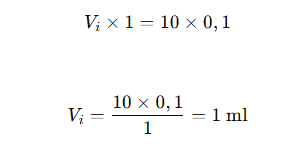
Se debe tomar 1 ml de HCl 1M y completar hasta 10 ml con agua.
Densidad
La densidad indica la relación entre el peso de un mililitro de solución y el peso de un mililitro de agua pura a 4°C (1 g/ml).
Cuando se preparan diluciones a partir de soluciones concentradas, la densidad del compuesto es un dato clave.
Se calcula con la fórmula:
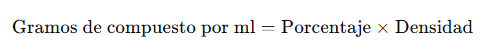
Ejemplo:
El HCl concentrado tiene una densidad de 1,25 g/ml y un 20% de concentración.
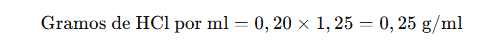
Recuerda que…
🔹 La molaridad expresa los moles de soluto por litro de disolución.
🔹 La molalidad indica los moles de soluto por kilogramo de disolvente.
🔹 La normalidad mide los equivalentes-gramo de soluto por litro de disolución.
🔹 Las diluciones permiten ajustar la concentración de una disolución sin modificar la cantidad total de soluto.
1.6. Preparación de soluciones tampón
Concepto de pH
Una de las mediciones más comunes en el laboratorio es la determinación del pH , que representaH⁺) en una medida indirecta de la concentración de protones (H⁺) en una solución.
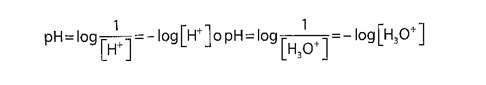
Para una disolución neutra:
pH = −log 10−7 = -(7) log 10 = 7
- Si el pH es menor a 7, la disolución es ácida .
- Si el pH es mayor a 7, la disolución es básica o alcalina .
- Un pH de 7 indica que la disolución es neutra .
Disoluciones neutras, ácidas y alcalinas
- Disolución neutra : Tiene un pH de 7 , como el agua pura.
- Disolución ácida : Presenta un pH menor a 7 . Las sustancias ácidas comparten ciertas propiedades:
- Tienen un sabor agrio.
- Conduce electricidad en solución acuosa.
- Liberan gas hidrógeno ( H₂ ) al reaccionar con ciertos metales (Mg, Zn, etc.).
- Reaccionan con mármol desprendiendo CO₂ .
- Cambian de color en presencia de ciertos indicados
- Disolución básica o alcalina : Tiene un pH mayor a 7 . Sus características incluyen:
- Sabor amargo y textura resbaladiza.
- Conducción de electricidad en solución acuosa.
- Reacción con ácidos formando compuestos con propiedades distintas.
- Cambio de color en los indicadores.
Según Arrhenius , los ácidos y bases muestran sus propiedades únicamente cuando están disueltos en agua. Su teoría de la disociación iónica explica:
- Ácidos : Sustancias que, en agua, liberan iones H⁺ .
- Bases : Sustancias que, en agua, liberan iones OH⁻ .
Si un ácido o base se disocia completamente en agua, se considera fuerte . Si solo se disocia parcialmente, se clasifica como débil .
Escala de pH
La escala de pH permite clasificar sustancias en ácidas o básicas y varía entre 0 y 14 :
- pH menor a 7 → Ácido
- pH mayor a 7 → Básico o alcalino
- pH igual a 7 → Neutro
El pH mide la concentración de iones H⁺ en una disolución:
- Mayor acidez → Mayor concentración de H⁺ → Menor pH .
- Mayor basicidad → Menor concentración de H⁺ → Mayor pH .
Soluciones tampón o buffer
Las soluciones tampón (también llamadas amortiguadoras o reguladoras ) tienen la capacidad de mantener un pH estable , incluso si se añaden ácidos o bases en cantidades considerables.
Una solución tampón está compuesta por:
- Un ácido débil y su base conjugada .
- Una base débil y su sal derivada de un ácido fuerte .
Ejemplos de soluciones tampón:
- Tampón ácido : Ácido acético + Acetato de sodio.
- Tampón básico : Hidróxido amónico + Cloruro amónico.
Métodos para medir el pH
El pH de una solución se puede determinar mediante:
- Indicadores ácido-base (sustancias que cambian de color según el pH).
- Medidores de pH (instrumentos electrónicos de medición).
Indicadores ácido-base
Los indicadores ácido-base son sustancias que cambian de color en función del pH de la disolución. Esto ocurre porque sus formas ácida y básica tienen colores diferentes .
Ejemplo:
- Rojo de metal :
- Amarillo a pH > 4,2.
- Rojo a pH < 3.
Cada indicador tiene un intervalo de pH en el cual cambia de color. Si el pH de la solución está dentro de ese intervalo, el color observado será una mezcla de los dos colores extremos.
Indicadores más utilizados
A continuación, algunos indicadores comunes y los rangos de pH en los que cambian de color:
| Indicador | Color en medio ácido | Color en medio básico | Rango de pH |
|---|---|---|---|
| Rojo de cresol | Rojo | Amarillo | 0 – 2 |
| Violeta de metal | Amarillo | Violeta | 0 – 2 |
| Naranja de metal | Rojo | Amarillo | 3 – 4 |
| Rojo congo | Azul | Rojo | 3 – 5 |
| Rojo de metal | Rojo | Amarillo | 4 – 6 |
| Azul de bromotimol | Amarillo | Azul | 6 – 8 |
| Tornasol | Rojo | Azul | 5,5 – 8,5 |
| Rojo fenol | Amarillo | Rojo | 6.5 – 8 |
| Azul de timol | Rojo | Azul | 1 – 9 |
| Fenolftaleína | Incoloro | Rojo | 9 – 10 |
Indicador universal
El indicador universal cambia de color en función del rango de pH , a partiendo desde pH 1 (rojo) hasta pH > 9 (azul) . La variación de colores en la escala de pH es la siguiente:
- Rojo-Cereza (pH 1).
- Cereza-Rojo (pH 2).
- Rojo-Anaranjado (pH 3).
- Anaranjado (pH 4).
- Anaranjado-Amarillo (pH 5).
- Amarillo-Verde (pH 6).
- Verde-Azul (pH 7-9).
pH-Metros
Los pH-metros son dispositivos que funcionan a partir de la relación entre la fuerza electromotriz de una pila y los potenciales redox de sus electrodos, así como la composición de la disolución en la que están sumergidos. El principio se basa en encontrar un electrodo cuya respuesta dependa de la actividad de los iones H+ en la solución y medir la diferencia de potencial generada al combinarlo con un electrodo de referencia con potencial conocido. De este modo, se puede determinar el pH de la solución mediante un método potenciométrico.
Cuando un electrodo se sumerge en una disolución, se genera una diferencia de potencial entre la solución interna del electrodo y la solución en estudio. Esta variación depende de la concentración de iones H+ en la muestra. Para medir esta diferencia, se emplea un electrodo de vidrio junto con otro de referencia.
El dispositivo utilizado para esta medición se llama pH-metro y está compuesto por:
- Un potenciómetro, que mide la diferencia de potencial.
- Un medidor, que muestra el valor del pH.
- Un electrodo de vidrio, que detecta la concentración de iones H+.
- Un electrodo de referencia, que proporciona un potencial constante.
Generalmente, el electrodo de referencia está formado por un electrodo de plata cubierto con cloruro de plata (Ag/AgCl) e inmerso en una solución de HCl 1 M, protegido por una membrana de vidrio.
Errores en la medición del pH
En algunos casos, pueden producirse errores en la medición:
- Error alcalino: si el pH de la muestra es mayor a 9, la membrana de vidrio puede responder también a cationes alcalinos, afectando la precisión.
- Error ácido: si el pH es inferior a 0,5, pueden presentarse desviaciones en la lectura.
Para obtener valores exactos, el pH-metro debe calibrarse inicialmente con una solución tampón de pH conocido, ajustando el dispositivo hasta que coincida con el valor esperado. Luego, se realiza una segunda calibración con otro tampón, generalmente con un pH cercano al de la muestra a analizar.
Calibración del pH-metro
La relación entre la diferencia de potencial y los valores de pH de las soluciones de referencia y la muestra se establece mediante la ecuación de Nernst.
Si ambas soluciones tienen el mismo pH, la diferencia de potencial entre los electrodos será nula. Para la calibración, se emplean soluciones tampón con valores específicos de pH. Por ejemplo, si se utiliza una solución de referencia con pH 6.840, se ajusta la lectura a ese valor. Con una segunda solución tampón de pH 7.348, la diferencia de potencial debería ser de aproximadamente 33,5 mV, permitiendo la calibración con dos puntos de referencia.
Cuidado y manejo de los electrodos
El mantenimiento adecuado de los electrodos es fundamental para obtener mediciones precisas y prolongar su vida útil. Algunos problemas comunes incluyen:
- Formación de burbujas, que pueden reducir el área efectiva de contacto con la disolución.
- Dificultades en el encaje del electrodo en su alojamiento.
- Necesidad de limpieza periódica, con productos específicos y en los momentos adecuados.
- Rotura de la membrana, que puede afectar la precisión o inutilizar el electrodo.
Procedimiento para la medición del pH
Antes de iniciar la medición, los electrodos y el recipiente deben lavarse con agua destilada y secarse con un paño absorbente. Es importante que las soluciones patrón y la muestra analizada estén a temperaturas similares, ajustando el pH-metro en consecuencia.
Para la calibración, se seleccionan dos soluciones tampón con valores de pH superior e inferior al esperado en la muestra. Con los electrodos sumergidos en la primera solución, se ajusta el botón de asimetría hasta que el aparato indique el valor correcto. Este proceso se repite con una segunda solución tampón.
Después de lavar y secar los electrodos, se introduce la muestra problema y se mide su pH. Se considera que la medición es correcta cuando las lecturas sucesivas presentan una variación menor a ±0,02 unidades de pH en soluciones bien amortiguadas o ±0,1 unidades en soluciones sin amortiguar.
Cuidados adicionales para los electrodos
- Los electrodos no deben dejarse secar después de su uso. Se ha comprobado que su vida útil aumenta alrededor de un 30% si se mantienen sumergidos en agua o en una solución tampón cuando no están en uso.
- Si se van a utilizar para medir pH superiores a 9, pueden almacenarse en una solución de bórax o en un tampón de pH 9.
- Cuando se realizan mediciones en disolventes no acuosos, es recomendable sumergir el electrodo en agua periódicamente para mantener su rendimiento.
- Se debe evitar el contacto brusco del electrodo con el recipiente o el agitador, ya que su extremo de vidrio es frágil y puede rayarse o romperse.
- Si no es posible calibrar correctamente el electrodo con los tampones utilizados, podría estar dañado. Antes de descartarlo, se puede intentar regenerarlo sumergiéndolo en HCl 6 M y luego enjuagándolo bien con agua destilada.
- En algunas ocasiones, los electrodos se recubren con una capa de silicona para evitar que se ensucien y mejorar su rendimiento en soluciones viscosas.
- En disoluciones coloidales, suspensiones o emulsiones, las mediciones pueden presentar errores debido a la interferencia con la membrana de vidrio.
El pH-metro funciona de manera óptima con una humedad relativa entre el 20% y el 60%. En ambientes demasiado secos, pueden producirse errores por acumulación de cargas estáticas, mientras que en condiciones de alta humedad, puede haber pérdidas eléctricas que afectan la precisión de las mediciones.
Dado que el electrodo de hidrógeno se toma como referencia con un potencial de valor cero a cualquier temperatura, no existe un método universalmente preciso para comparar la actividad del ion hidrógeno a distintas temperaturas.
1.7. Centrifugación
Introducción
La centrifugación es una técnica eficaz, rápida y limpia utilizada para separar un sólido en suspensión dentro de un líquido. Su principio de funcionamiento se basa en aplicar una velocidad de rotación a la muestra, lo que provoca que las partículas más densas se acumulen en el fondo del recipiente, formando el precipitado, mientras que las más ligeras permanecen en la parte superior, en el sobrenadante.
Las centrífugas están compuestas por los siguientes elementos:
- Rotor o cabezal:
Es la parte donde se colocan las muestras. Este componente gira y puede ser de dos tipos:- Cabezal horizontal u oscilante: permite que los tubos cambien de posición durante el giro.
- Cabezal angular o de ángulo fijo: los tubos permanecen en un ángulo determinado respecto al eje.
- Eje de la centrífuga:
Es el componente alrededor del cual gira el rotor. - Motor:
Es el encargado de generar el movimiento del sistema. - Accesorios:
Incluyen la carcasa protectora, la tapa y otros elementos adicionales que pueden variar según el tipo de centrífuga.
La velocidad de funcionamiento de una centrífuga se mide en revoluciones por minuto (rpm), mientras que la fuerza generada durante la rotación se expresa como fuerza centrífuga relativa (FCR), que se cuantifica en términos de la aceleración de la gravedad (g). La relación entre rpm y FCR se determina mediante la siguiente ecuación:
Donde: Fcr = 1,12 x 10 x n x r
- n es la velocidad de rotación del rotor (en rpm).
- r es el radio de la centrífuga (en centímetros), medido desde el centro del rotor hasta el fondo del tubo portamuestras.
Para facilitar los cálculos, existen nomogramas que permiten relacionar directamente la FCR con la velocidad de giro.
En los laboratorios, se pueden encontrar diferentes tipos de centrífugas, algunas de ellas cuentan con sistemas de control de temperatura que permiten ajustar el calor generado en función de la naturaleza de la muestra. Además, pueden ser de velocidad fija o ajustable según los requerimientos del análisis.
Usos
La centrifugación tiene diversas aplicaciones, entre las cuales se destacan:
- Obtención de suero o plasma a partir de sangre total:
Mediante la centrifugación, los componentes celulares de la sangre se depositan en el fondo del tubo, mientras que el sobrenadante será suero si no se ha añadido anticoagulante o plasma si se ha agregado un agente anticoagulante. Generalmente, una fuerza centrífuga de 1.000 g aplicada durante aproximadamente 10 minutos es suficiente para lograr una separación efectiva.Para mejorar este proceso, existen tubos con un gel de silicona en el fondo. Este gel tiene una densidad intermedia entre la del suero y la del coágulo sanguíneo. Durante la centrifugación, el gel se desplaza hasta situarse entre ambas fases, facilitando la separación del suero. - Concentración de células en líquidos biológicos:
En muestras como orina, líquido cefalorraquídeo o líquido sinovial, donde la cantidad de células es baja, la centrifugación permite concentrarlas, facilitando su análisis. - Separación de fases en técnicas de extracción con disolventes orgánicos:
En ciertos procedimientos analíticos, es necesario separar distintas fases de una solución. La centrifugación ayuda a mejorar esta separación.
Centrífugas Especiales
Para ciertas aplicaciones, se emplean centrífugas diseñadas específicamente para cumplir con funciones particulares:
- Centrífuga de microhematocrito:
Se utiliza en laboratorios clínicos para medir el hematocrito, que indica la proporción de células en la sangre. Este tipo de centrífuga opera a una velocidad constante y alcanza hasta 10.000 rpm, lo que permite una rápida separación de los elementos celulares. En lugar de tubos convencionales, emplea capilares para la medición. - Ultracentrífugas:
Son dispositivos de alta velocidad, diseñados para alcanzar velocidades de rotación extremadamente elevadas. Para minimizar el calentamiento y la fricción durante el proceso, cuentan con un sistema de vacío en el compartimento donde se encuentra el rotor. Esto reduce la resistencia al movimiento y evita que las muestras se sobrecalienten.
La elección del tipo de centrífuga dependerá del análisis que se requiera realizar y de las características de la muestra a procesar.
Control y mantenimiento
Para garantizar un funcionamiento óptimo y evitar posibles contaminaciones o daños en la centrífuga, es fundamental mantener los rotores o cabezales en buen estado, asegurando que estén siempre limpios y sin residuos que puedan afectar la estabilidad del sistema.
Al utilizar una centrífuga, es importante seguir ciertas recomendaciones:
- Uso de tubos adecuados: Se deben emplear tubos resistentes que no se rompan durante el proceso. Para minimizar impactos y evitar el movimiento del sobrenadante, se recomienda colocar un amortiguador en el fondo del adaptador. Además, es fundamental verificar que los tubos no sobresalgan del portatubos, ya que esto podría impedir la oscilación en centrífugas con cabezal oscilante.
- Equilibrado correcto: Para evitar daños en el rotor y el eje de giro, las muestras deben colocarse de manera simétrica, con pesos iguales en posiciones opuestas dentro de la centrífuga.
- Cubrir los recipientes: Tapar los tubos evita la evaporación y el aumento de temperatura generado por el rozamiento, además de prevenir la formación de aerosoles que podrían ser contaminantes.
- No detener la centrífuga bruscamente: Interrumpir de forma repentina el giro puede provocar la mezcla de las fases ya separadas, además de representar un posible riesgo de accidente.
- Verificación periódica de la velocidad: Para garantizar la precisión del equipo, se debe comprobar la velocidad de centrifugación cada tres meses con un estroboscopio ligero o un tacómetro de alta precisión.
- Limpieza regular: Es fundamental limpiar la cámara y los recipientes periódicamente, y especialmente después de la rotura de un tubo, para evitar la propagación de posibles agentes infecciosos.
- Revisión del temporizador: Se recomienda compararlo semanalmente con un temporizador de referencia para asegurarse de su exactitud.
- Control de temperatura en centrífugas refrigeradas: Se debe comprobar al menos una vez al mes para asegurar que el sistema de enfriamiento funcione correctamente.
- Mantenimiento de los componentes eléctricos: Elementos como conmutadores, escobillas y cepillos del motor deben inspeccionarse cada tres meses y sustituirse si es necesario.
Tipos de centrífugas
En el laboratorio, las centrífugas pueden variar en su diseño y funcionalidades. Algunas cuentan con sistemas para regular la temperatura, lo que permite adaptarlas según el tipo de muestra. También pueden ser de velocidad ajustable o fija.
Según su rango de velocidades, se pueden clasificar en los siguientes tipos:
a) Centrífugas de baja velocidad (de sobremesa o clínicas)
Son compactas y no cuentan con sistema de refrigeración. Su velocidad máxima es de aproximadamente 5.000 rpm, por lo que se emplean en la separación de partículas grandes, como células o precipitados de sales insolubles.
Una variante de estas son las centrífugas micrófugas, diseñadas para trabajar con volúmenes reducidos y alcanzar velocidades superiores a 10.000 rpm, siendo muy utilizadas en biología molecular.
b) Centrífugas de alta velocidad
Pueden operar entre 18.000 y 25.000 rpm, cuentan con sistemas de refrigeración y algunas incluyen un mecanismo de vacío para minimizar el calentamiento del rotor por fricción con el aire. Se utilizan en la separación de fracciones celulares, aunque no son lo suficientemente rápidas para separar partículas más pequeñas como ribosomas, virus o macromoléculas.
c) Ultracentrífugas
Superan las 50.000 rpm, por lo que requieren sistemas avanzados de refrigeración y vacío para minimizar la fricción y el calentamiento.
Existen dos tipos principales de ultracentrífugas:
- Analíticas: Permiten obtener datos precisos sobre la sedimentación de partículas, como coeficientes de sedimentación y pesos moleculares.
- Preparativas: Se utilizan para aislar partículas con bajos coeficientes de sedimentación, como virus, micromoléculas y microsomas.
Tipos de centrifugación
Centrifugación diferencial
Este método consiste en llenar un tubo de centrífuga con una mezcla homogénea y someterla a la fuerza centrífuga. Como resultado, se obtienen dos fracciones:
- Pellet: Contiene el material sedimentado.
- Sobrenadante: Contiene las partículas que no han sedimentado.
Se emplea principalmente para la separación de células y orgánulos subcelulares, basándose en las diferencias de tamaño de las partículas.
El procedimiento implica la aplicación de fuerzas de centrifugación progresivas durante periodos de tiempo crecientes. Con cada paso, se obtienen precipitados enriquecidos con distintos tipos de partículas. Para que la separación sea efectiva, los coeficientes de sedimentación de las partículas deben diferir al menos en un factor de tres, lo que significa que las partículas con un coeficiente de sedimentación mayor precipitan primero.
El coeficiente de sedimentación (S) se define como la velocidad a la que una partícula se asienta bajo la influencia de la fuerza centrífuga. Su valor depende de la masa y densidad de la partícula, así como de la densidad del medio y del coeficiente de fricción, el cual varía en función de la forma de la partícula.
Matemáticamente, el coeficiente de sedimentación se expresa como:
Donde:
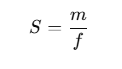
- S es el coeficiente de sedimentación.
- m representa la masa de la partícula.
- f es el coeficiente de fricción.
La unidad de medida del coeficiente de sedimentación es el Svedberg (S), equivalente a 10⁻¹³ segundos, en agua a 20 °C.
Centrifugación mediante un gradiente de densidades
Este método de centrifugación permite la separación de partículas con base en sus diferencias de densidad dentro de un fluido líquido. Aunque es un proceso más complejo que la centrifugación diferencial, ofrece ventajas significativas que justifican el esfuerzo adicional. Este procedimiento permite no solo separar los distintos componentes de una muestra, sino también realizar análisis más detallados.
El gradiente de densidad se genera utilizando un soporte fluido cuya densidad aumenta progresivamente desde la parte superior hasta la inferior. Para crear este gradiente, se utilizan solutos de baja masa molecular que permiten suspender adecuadamente la muestra en la solución. Entre los solutos más comunes se encuentran la sacarosa, los polisacáridos sintéticos, ciertos derivados del ácido benzoico y sales de metales alcalinos pesados como el cesio o el rubidio.
La muestra se deposita en la capa superior del gradiente en forma de una fina banda. Luego, al aplicar la centrifugación, los distintos componentes de la muestra se separan en diferentes niveles dentro del gradiente, formando bandas bien definidas que pueden extraerse individualmente para su análisis.
Este método tiene dos variantes principales: centrifugación zonal y centrifugación isopícnica.
A) Centrifugación zonal
En esta técnica, la muestra se coloca en la parte superior de un gradiente de densidades previamente formado. Bajo la acción de la fuerza centrífuga, las partículas comienzan a desplazarse a velocidades que dependen de su masa, sedimentándose en diferentes niveles dentro del gradiente.
Un aspecto clave de este procedimiento es que la densidad máxima del gradiente no debe superar la densidad de las partículas que se van a separar. Esto permite que las partículas se distribuyan en bandas bien definidas dentro del tubo de centrifugación.
B) Centrifugación isopícnica
Este método se basa en la separación de partículas en función de su densidad en lugar de su tamaño o velocidad de sedimentación. Durante la centrifugación, las partículas migran dentro del gradiente hasta alcanzar una posición donde su densidad es igual a la del medio circundante, permaneciendo allí sin seguir sedimentando.
A diferencia de la centrifugación zonal, en la isopícnica la densidad del gradiente debe ser mayor que la de las partículas analizadas. Esto garantiza que las partículas flotarán sobre un “colchón” de material más denso, evitando que se acumulen en el fondo del tubo.
Este método es particularmente útil cuando se desea separar partículas de tamaño similar pero con diferentes densidades, como en el caso de los ácidos nucleicos y diversos orgánulos celulares.
C) Comparación entre centrifugación diferencial, zonal e isopícnica
1. Centrifugación diferencial
- Tipo de rotor: Se utiliza generalmente un rotor angular.
- Criterio de separación: Principalmente basado en el tamaño de las partículas, aunque también depende del coeficiente de sedimentación (S), que está relacionado con la masa y la forma de la partícula.
- Aplicaciones: Se emplea para la separación de distintos tipos celulares, fraccionamiento de orgánulos subcelulares y la separación de complejos macromoleculares.
2. Centrifugación zonal (o de velocidad de sedimentación)
- Tipo de rotor: Se emplea un rotor basculante.
- Criterio de separación: Se basa en el coeficiente de sedimentación, que depende de la masa y la forma de la partícula. El gradiente previene la mezcla de las muestras por convección o difusión, lo que permite obtener bandas bien definidas. La centrifugación debe interrumpirse antes de que las partículas alcancen el equilibrio.
- Condiciones del gradiente: La densidad máxima del gradiente no debe ser superior a la de los componentes de la muestra.
- Aplicaciones: Se utiliza para separar macromoléculas y orgánulos celulares de características similares.
3. Centrifugación isopícnica (o de equilibrio de sedimentación)
- Tipo de rotor: Se emplea un rotor basculante.
- Criterio de separación: Se basa únicamente en la densidad de las partículas. Al igual que en la zonal, el gradiente evita la mezcla de las muestras por convección o difusión, pero en este caso, la centrifugación continúa hasta que las partículas alcanzan el equilibrio.
- Condiciones del gradiente: La densidad máxima del gradiente debe ser mayor que la de las partículas de la muestra.
- Aplicaciones: Es especialmente útil para separar y purificar ácidos nucleicos y otros compuestos con diferencias de densidad.
Cada tipo de centrifugación tiene sus propias ventajas y es seleccionado en función de los requisitos específicos del análisis que se vaya a realizar.
Métodos de barrera
El método de barrera es una técnica rápida utilizada para la separación de leucocitos de la sangre sin la presencia de otras células sanguíneas. Se basa en un proceso de centrifugación en el que la muestra atraviesa un medio de densidad constante.
Para que este método sea efectivo, es fundamental que la densidad del medio sea intermedia entre las densidades de los diferentes tipos celulares a separar. Existen medios comerciales diseñados específicamente para este propósito, que suelen estar compuestos por mezclas de Ficoll (un polisacárido sintético) y metrizamida (un compuesto yodado sintético).
Algunos de los medios utilizados para la separación de células específicas incluyen:
- Nycoprep-1077: Diseñado para aislar células mononucleares.
- Nycoprep-1068: Específico para la separación de monocitos.
- Polymorphoprep: Adecuado para células polimorfonucleares.
- Nycoprep-1063: Utilizado en la obtención de plaquetas.
Material necesario para la centrifugación
Independientemente del tipo de centrifugación empleada, el equipo principal requerido es una centrífuga. Esta máquina está compuesta por:
- Un motor, que genera el movimiento de rotación.
- Un rotor, diseñado para sostener los tubos de muestra.
- Un compartimento, que alberga el motor y lo aísla del exterior.
Cuando la centrífuga opera a velocidades muy altas, el compartimento suele estar sellado herméticamente y refrigerado para evitar el sobrecalentamiento del rotor. En algunos casos, este compartimento está blindado para minimizar riesgos en caso de una falla mecánica o rotura del rotor.
Las centrífugas modernas permiten ajustar diversos parámetros según el tipo de muestra y el procedimiento a realizar:
- Velocidad: Expresada en revoluciones por minuto (rpm), determina la intensidad de la fuerza centrífuga aplicada.
- Tiempo: Se regula según el tiempo necesario para una correcta separación de los componentes.
- Temperatura: En ciertas aplicaciones, se requiere control térmico para preservar la integridad de la muestra.
Existen diferentes tipos de rotores según la aplicación específica, y los tubos empleados en la centrifugación pueden ser de vidrio o plástico, siempre que sean resistentes a los productos químicos utilizados y capaces de soportar las fuerzas generadas por la alta velocidad de rotación.
Recomendaciones para el uso adecuado de la centrífuga
Para garantizar un funcionamiento seguro y eficiente de la centrífuga, es importante seguir ciertas precauciones:
- Uso de tubos resistentes: Se deben emplear tubos adecuados que no se rompan durante el proceso de centrifugación.
- Equilibrado adecuado: Las muestras deben distribuirse de manera uniforme dentro de la centrífuga, colocando tubos de igual peso en posiciones opuestas para evitar el desbalanceo del rotor y posibles daños en el eje de giro.
- Tapa de los recipientes: Se deben cubrir los tubos para evitar la evaporación, lo que podría causar un aumento de la temperatura dentro de la cámara debido al rozamiento, así como para prevenir la formación de aerosoles que podrían ser perjudiciales.
- Limpieza periódica: Se debe realizar una limpieza regular de la cámara y los recipientes de la centrífuga, especialmente después de la rotura de un tubo, para evitar la propagación de contaminantes o agentes infecciosos.
Siguiendo estas indicaciones, se garantiza un uso seguro y eficiente de la centrífuga, optimizando la calidad de los resultados obtenidos en los diferentes procedimientos de laboratorio.


